
【题目】根据如图回答,下列说法不正确的是

A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为O2+4e-+4H+![]() 2H2O
2H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
科目:高中化学 来源: 题型:
【题目】标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023 HCl分子③13.6g H2S ④0.2mol NH3。下列对四种气体的关系从小到大表示不正确的是( )
A.物质的量:④<①<③<②B.体积:④<①<②<③
C.质量:④<①<③<②D.氢原子个数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到ClO﹣、NH4+、N2、Cl﹣等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是
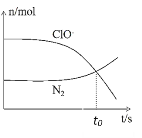
A. 该反应中ClO-为氧化剂,N2为氧化产物
B. 反应后溶液的pH减小
C. 如图t0时反应达平衡状态
D. 反应过程中每生成1 mol N2,转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据氧化还原反应:2Ag+(aq)+ Cu(s)== Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是_____。
(2)银电极上发生的电极反应为________; X电极上发生的电极反应为____________。
(3)图中所示连接的盐桥(U型管中装有饱和KNO3溶液)装置,将其放置于电解质溶液中,此时盐桥中的K+移向__________(填“CuSO4溶液”或“Y溶液”),形成闭合回路,构成原电池。
II、如图所示,甲、乙为相互串联的两个电解池。请回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极为________极,电极反应为________。溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。

(2)乙池中Fe极电极反应为______________若在乙池中滴入少量酚酞溶液,电解一段时间后,铁极附近呈__________色。
(3)若甲池A极增重12.8 g,则乙池C(石墨)极放出气体在标准状况下的体积为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是____________。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是__________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是____(请简述理由,并且写出对应的离子反应方程式)。
(3)步骤Ⅲ,合适的pH范围是____________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_____________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如下图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_______方式进行冷却结晶。

A. 快速降温 B. 缓慢降温 C. 变速降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com