
【题目】已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
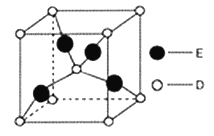
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)
【答案】 氮 氧 3d104s1 Cr sp2 ∠HCO>∠HCH 直线形 NH3分子间能形成氢键 A B D 4 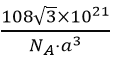
【解析】因为“B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。”,推出 B的电子排布式为1s22s22p2, 所以B为6号碳元素;根据A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,这种气体指的是甲醛HCHO,A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素,所以A为1号氢元素;D原子有2个未成对电子,则D为8号氧元素,同时推出C为7号氮元素;含E元素的硫酸盐溶液是制备波尔多液的原料之一,则E为29号铜元素。
(1). 五种元素中第一电离能最大的是氮,因为它的2p轨道是半充满较稳定结构,电负性最大的是氧,因为氧的非金属性在五种元素中最强。
(2). 基态E原子为29号铜元素,其价电子排布式为符合洪特规则(3d全充满时较稳定)的3d104s1,而不是3d94s2;E元素所在周期中基态原子的成单电子数最多的元素是 Cr,其价电子排布为3d54s1,根据洪特规则,3d轨道的5个电子要分占5个伸展方向不同的轨道并且自旋状态相同,所以不对成电子数为6.
(3). 甲醛分子中C原子形成3个σ键和一个π键,所以C原子的轨道杂化类型为sp2 ,由于甲醛分子中C原子与O原子之间形成的是双键,电子云密度较大,对C原子与H原子之间形成的一个共用电子对有较大的排斥作用,所以M分子中两种键角的大小关系是∠HCO>∠HCH。
(4). N3-的结构式为[N![]() N
N![]() N]-,中心原子N采用sp杂化轨道与两边的N成键,所以其空间构型为直线形;化合物NH3的沸点比CH4的高,其主要原因是NH3分子间能形成氢键。
N]-,中心原子N采用sp杂化轨道与两边的N成键,所以其空间构型为直线形;化合物NH3的沸点比CH4的高,其主要原因是NH3分子间能形成氢键。
(5). 向硫酸铜溶液中通入过量的NH3,得到深蓝色的[Cu(NH3)4]SO4溶液,在此溶液中加入乙醇,析出深蓝色的[Cu(NH3)4]SO4晶体, [Cu(NH3)4]SO4晶体中存在的化学键类型有离子键、σ键、配位键。
(6).该晶胞为正方体,每个晶胞中含4个铜原子、2个氧原子,则该化合物的化学式为Cu2O。由图可知距O周围最近有4个Cu,所以O的配位数为4 。晶胞中最近两个O原子为顶点到体心间距为anm,由此可求出正方体边长为![]() nm。1mol此晶胞中含2molCu2O,质量为288g,体积为(
nm。1mol此晶胞中含2molCu2O,质量为288g,体积为(![]() nm)3NA,则该晶体的密度为
nm)3NA,则该晶体的密度为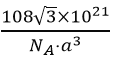 g/cm3
g/cm3


科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑上述反应中能设计成原电池的是______。
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入_____________极(填a或b),电子从 __________(填a或b)极流出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
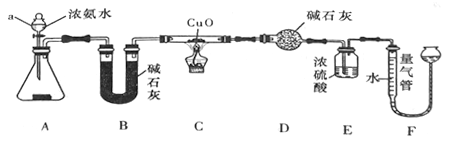
(1)仪器a的名称为______________。
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,最气管中有无色无味的气体产生。上述现象证明NH3 具有______性,写出相应的化学方程式:______________。
(3)E装置中浓硫酸的作用是______________。
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为VL(已折算成标准状况),则氨分子中氮、氢的原子个数比值为_____(用含m、V字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡混合物加压后颜色变深
C.向氯水中加适量NaHCO3后,溶液漂白能力增强
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中每种物质都既有离子键又有共价键的一组是( )。
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、HNO3
C.Ba(OH)2、Na2CO3、Na3PO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书·食货志》记载“金谓五色之金也,其黄者曰金,白者曰银,赤者曰铜,黑者曰铁……”文中所述金属能与浓盐酸反应生成氢气的是
A. 金 B. 银 C. 铜 D. 铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.
(1)含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是____。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为__________。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 (填字母)
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)3晶体的方法如下:
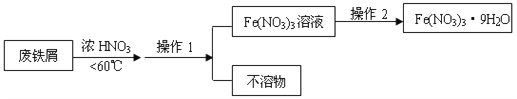
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为_______________。
②磁性氧化铁的化学式为______,试写出Fe2O3与硝酸反应的离子方程式_________________。
③操作1的名称为_____,操作2的步骤为:_____________,过滤,洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A. 酸雨是pH小于7的雨水
B. H2O与D2O互为同位素
C. 滴定管装标准液前应先用标准液润洗2~3次
D. SO2使酸性KMnO4溶液褪色,体现了SO2漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com