
 ����������Ԫ��A��B��C��D��E��F��ԭ����������������֪A��ԭ�Ӱ뾶��B��С��B�ڷ�Ӧ�мȲ����õ�����Ҳ������ʧȥ���ӣ�CԪ�ص���̬�⻯���������������Ӧˮ�����ܻ��������Σ�Ԫ��D��ԭ������������������Ӳ�����3����E��Aͬһ���壬F�������ư뵼�壮
����������Ԫ��A��B��C��D��E��F��ԭ����������������֪A��ԭ�Ӱ뾶��B��С��B�ڷ�Ӧ�мȲ����õ�����Ҳ������ʧȥ���ӣ�CԪ�ص���̬�⻯���������������Ӧˮ�����ܻ��������Σ�Ԫ��D��ԭ������������������Ӳ�����3����E��Aͬһ���壬F�������ư뵼�壮
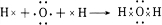 ��д��A2D��X��Ӧ�Ļ�ѧ����ʽ�����õ����ű������ת��
��д��A2D��X��Ӧ�Ļ�ѧ����ʽ�����õ����ű������ת��
���� ����������Ԫ��A��B��C��D��E��F��ԭ��������������CԪ�ص���̬�⻯���������������Ӧˮ�����ܻ��������Σ���CΪNԪ�أ�Ԫ��D��ԭ������������������Ӳ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����DΪOԪ�أ�B�ڷ�Ӧ�мȲ����õ�����Ҳ������ʧȥ���ӣ�ԭ������С��N������A����A��ԭ�Ӱ뾶��B��С����BΪ̼Ԫ�ء�AΪHԪ�أ�E��Aͬһ���壬E��ԭ����������������EΪNa��F�������ư뵼�壬��FΪSi���ݴ˽��
��� �⣺����������Ԫ��A��B��C��D��E��F��ԭ��������������CԪ�ص���̬�⻯���������������Ӧˮ�����ܻ��������Σ���CΪNԪ�أ�Ԫ��D��ԭ������������������Ӳ�����3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����DΪOԪ�أ�B�ڷ�Ӧ�мȲ����õ�����Ҳ������ʧȥ���ӣ�ԭ������С��N������A����A��ԭ�Ӱ뾶��B��С����BΪ̼Ԫ�ء�AΪHԪ�أ�E��Aͬһ���壬E��ԭ����������������EΪNa��F�������ư뵼�壬��FΪSi��
��1��D��E�γɵ�һ�ֻ�����X�к����������͵Ļ�ѧ������XΪNa2O2��X����ʽΪ  ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��B��C��D��F�γɵ���̬������ֱ�ΪCH4��NH3��H2O��SiH4���ǽ�����O��N��C��Si�����⻯���ȶ��ԣ�H2O��NH3��CH4��SiH4���ʴ�Ϊ��H2O��NH3��CH4��SiH4��
��3���õ���ʽ��ʾH2O���γɹ��̣�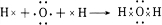 ��H2O��Na2O2��Ӧ�õ����ű������ת��Ϊ��
��H2O��Na2O2��Ӧ�õ����ű������ת��Ϊ�� ��
��
�ʴ�Ϊ��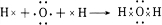 ��
�� ��
��
��4����ʼ��Ӧ��Ӧ��Na2CO3+HCl�TNaHCO3+NaCl�����ɶ�����̼������Ӧ��NaHCO3+HCl�TNaCl+H2O+CO2������������̼���������Ʒ�Ӧ��ֻ����Na2CO3����ǰ�������������֮��Ϊ1��1��ͼ����ǰ�������������֮��Ϊ1��2����˵��������̼���������Ʒ�Ӧ��ֻ����Na2CO3��NaHCO3���ɷ���ʽ��֪�������ʵ���֮��Ϊ1��1����Ԫ���غ��֪CO2��NaOH�����ʵ���֮��Ϊ2��3��CO2��NaOH��ط�Ӧ�Ļ�ѧ��Ӧ����ʽ��CO2+2NaOH=Na2CO3+H2O��CO2+NaOH=NaHCO3��������������εμ���������ӷ�Ӧ����ʽ��CO32-+H+=HCO3-��HCO3-+H+=CO2��+H2O��
�ʴ�Ϊ��2��3��CO2+2NaOH=Na2CO3+H2O��CO2+NaOH=NaHCO3��CO32-+H+=HCO3-��HCO3-+H+=CO2��+H2O��
���� ���⿼��ṹ����λ�ù�ϵӦ�á�������йؼ��㣬��4���йؼ��Ǹ���ǰ������������������ж����ʣ��Ѷ��еȣ�


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ձ����ԹܼС�©���������� | B�� | �ձ����ƾ��ơ��Թܡ�©�� | ||
| C�� | ©�������������ձ�������̨ | D�� | ���������ձ���©���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ط��� | W | X | Y | Z |
| ԭ����Ϣ | ��ˮ������������ߵ�Ԫ�� | �ǽ�����ǿ�����ʣ�X2�����ȶ� | M���K����1������ | ��������Ԫ�صļ������а뾶��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��1L��0.1mol•L-1H2SO4��Һ | |
| B�� | T��1L 0.2mol•L-1H2SO4��Һ�м���1L 0.2mol•L-1NaOH��Һ��õ���2L��Һ | |
| C�� | 25��a mol•L-1NaHSO4��Һ[��֪50ml amol•L-1Ba��OH��2��Һ��100mL amol•L-1NaHSO4��Һ��Ϻ�pH=7] | |
| D�� | T��c��OH-��=10-13mol•L-1��ij����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.7g | B�� | 5.2g | C�� | 7.8g | D�� | 10g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺
������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com