
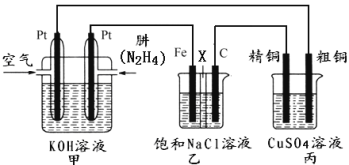
【题目】如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
根据要求回答相关问题:
(1)甲装置中通入____气体的一极为正极,其电极反应式为:__________。
(2)乙装置中石墨电极为_____极(填“阳”或“阴”,其电极反应式为_____;可以用_____检验该反应产物,电解一段时间后,乙池中的溶液呈_________性。
(3)图中用丙装置模拟工业中的_________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_________g。
(4)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为________。
【答案】空气 O2+4e-+2H2O=4OH- 阳 2Cl--2e-=Cl2↑ 湿润的淀粉碘化钾试纸 碱 粗铜的精炼 0.8 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】
(1)根据原电池反应原理,负极上失电子,正极上得电子,则正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-;答案为空气,O2+4e-+2H2O=4OH-。
(2)乙装置中石墨与电源正极相接,为阳极,阳极上氯离子失去电子生成氯气,发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸,观察是否变蓝,电解食盐水的总反应为2H2O+2Cl-![]() Cl2↑+H2↑+2OH-,电解后的溶液呈碱性;答案为阳,2Cl--2e-=Cl2↑,湿润的淀粉碘化钾试纸,碱。
Cl2↑+H2↑+2OH-,电解后的溶液呈碱性;答案为阳,2Cl--2e-=Cl2↑,湿润的淀粉碘化钾试纸,碱。
(3)装置丙中,粗铜作阳极,纯铜作阴极,所以该装置为粗铜精炼装置;原电池负极和纯铜电极上有:N2H4~N2~4e-,Cu~Cu2+~2e-,根据电子守恒得到关系式:N2H4~2Cu,n(N2H4)=![]() n(Cu)=
n(Cu)= ![]() ×
×![]() =0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g;答案为粗铜的精炼,0.8。
=0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g;答案为粗铜的精炼,0.8。
(4)将丙中的粗铜电极换为Pt电极,则Pt电极为惰性电极,装置为电解硫酸铜溶液装置,溶液中铜离子和氢氧根离子放电,生成Cu和O2,电解硫酸铜溶液的化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;答案为2CuSO4+2H2O
2Cu+O2↑+2H2SO4;答案为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。


科目:高中化学 来源: 题型:
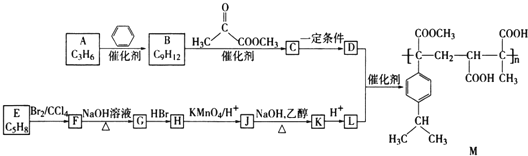
【题目】某高分子化合物M的合成路线如下:
已知:R-CH2OH![]() R-COOH表示饱和烃基
R-COOH表示饱和烃基![]() 回答下列问题:
回答下列问题:
(1)![]() 的反应类型是 ______ .
的反应类型是 ______ .
(2)![]() 的反应条件为 ______ .
的反应条件为 ______ .
(3)![]() 可以使溴的四氯化碳溶液褪色,则E的系统命名是 ______ .
可以使溴的四氯化碳溶液褪色,则E的系统命名是 ______ .
(4)设计反应![]() 和
和![]() 的目的是 ______ .
的目的是 ______ .
(5)![]() 有两种可能的结构,为了确定其结构可选用的仪器是 ______
有两种可能的结构,为了确定其结构可选用的仪器是 ______ ![]() 填代号
填代号![]() .
.
![]() 红外光谱仪
红外光谱仪![]() 质谱仪
质谱仪![]() 元素分析仪
元素分析仪![]() 核磁共振仪
核磁共振仪
(6)高分子化合物M的单体为 ______ ![]() 写结构简式
写结构简式![]() .
.
(7)![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
(8)与L具有相同官能团的L的同分异构体还有 ______ 种,其中核磁共振氢谱为3组峰,且面积比为3:2:1的是 ______ ![]() 写结构简式
写结构简式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
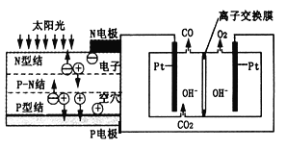
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧有很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中电晕放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是( )
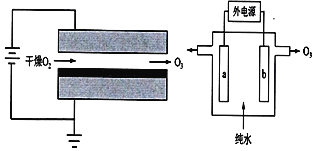
A.两种方法都是将电能转化为化学能
B.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
C.电晕放电法和电解纯水法相比,会产生污染性的NOx气体
D.电解纯水时,H+由电极b流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:
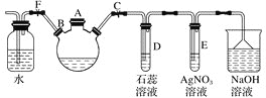
(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的有机化学方程式为______________________。
(2)D、E试管内出现的现象分别为:D.______, E.__________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为![]() ,硼砂的化学式为
,硼砂的化学式为![]() 。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
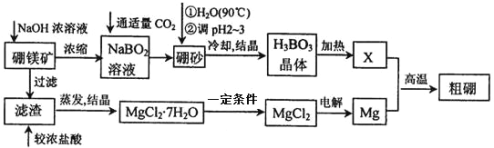
(1)写出硼元素在周期表中的位置_________________________
(2)将硼砂溶于热水后,用硫酸调节溶液的![]() 为23以制取硼酸
为23以制取硼酸![]() ,该反应的离子方程式为_________________________________________。
,该反应的离子方程式为_________________________________________。
(3)由![]() 制备
制备![]() 时,一定条件是_________________________________。
时,一定条件是_________________________________。
(4)制得的粗硼在一定条件下生成![]() ,
, ![]() 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的
粗硼制成的![]() 完全分解,将生成的
完全分解,将生成的![]() 配制成
配制成![]() 溶液,用酸式滴定管量取
溶液,用酸式滴定管量取![]() 碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用
碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。(提示:
。(提示:![]() )滴定终点的现象为____________,该粗硼样品的纯度为____________%
)滴定终点的现象为____________,该粗硼样品的纯度为____________%
Ⅱ (5)已知:![]() 的电离常数为
的电离常数为![]() ,
,![]() 的电离常数为
的电离常数为![]() 、
、![]() ,向盛有饱和硼酸溶液的试管中,滴加
,向盛有饱和硼酸溶液的试管中,滴加![]()
![]() 溶液,_____(填“能”或“不能”)观察到气泡逸出.
溶液,_____(填“能”或“不能”)观察到气泡逸出.
(6)![]() [也可写成
[也可写成![]() ]可以通过电解
]可以通过电解![]() 溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).
溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).

①![]() 膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
理论上每生成![]() ,阴极室可生成________
,阴极室可生成________![]() 气体(标准状况)
气体(标准状况)
②![]() 室中,进口和出口的溶液浓度大小关系为
室中,进口和出口的溶液浓度大小关系为![]() ________
________![]() (填“>”或“<”)
(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列化学反应的热现象,不正确的说法是 ( )
A.吸热反应都需要加热后才能发生
B.化学反应一定既有物质变化又有能量变化
C.有些放热反应发生时需要加热
D.化学反应热效应数值与反应物质多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在Pd表面选择加氢的反应机理如图所示。其中吸附在Pd表面上的物种用*标注。
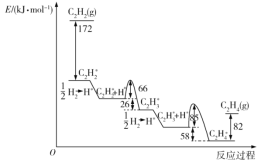
下列有关说法正确的是( )
A.该正反应历程中最大能垒(活化能)为85kJ·mol-1
B.吸附反应为吸热反应
C.Pd为固体催化剂,其表面积大小对催化效果无影响
D.C2H2*+H*→C2H3*只有化学键的形成过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com