
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g) ![]() N2+CO2(g)△H=﹣373.4kJ/mol在一容积为5L的恒容密闭容器中充人0.2mol NO和0.5mol CO,5min后该反应达到平衡,此时N2的物质的量为0.06mol.下列说法正确的是( )
N2+CO2(g)△H=﹣373.4kJ/mol在一容积为5L的恒容密闭容器中充人0.2mol NO和0.5mol CO,5min后该反应达到平衡,此时N2的物质的量为0.06mol.下列说法正确的是( )
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5min内,NO的反应速率为2.4×10﹣3molL﹣1min﹣1
【答案】C
【解析】解:A.正反应为放热反应,只升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,故A错误;
B.恒温恒容条件下,通入稀有气体,反应混合物各组分的浓度不变,正、逆反应速率都不变,故B错误;
C.平衡常数只受温度影响,使用催化剂,平衡常数不变,故C正确,
D.0~5min内,N2的平均速率= ![]() =2.4×10﹣3molL﹣1min﹣1,速率之比等于化学计量数之比,故v(NO)=2v(N2)=4.8×10﹣3molL﹣1min﹣1,故D错误,
=2.4×10﹣3molL﹣1min﹣1,速率之比等于化学计量数之比,故v(NO)=2v(N2)=4.8×10﹣3molL﹣1min﹣1,故D错误,
故选C.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知25°时,乙酸和三氯乙酸的电离常数分别是:Ka(CH3COOH)═1.80×10﹣5 , Ka(CCl3COOH)═0.60,在物质的量浓度均为0.1molL﹣1的CH3COONa和CCl3COONa混合溶液中,下列关系正确的是( )
A.c(Na+)═c(CCl3COO﹣)+c(CH3COO﹣)
B.c(CCl3COO﹣)﹣c(CH3COO﹣)═c(CH3COOH)﹣c(CCl3COOH)
C.c(OH﹣)>c(CCl3COO﹣)>c(CH3COO﹣)
D.c(CH3COOH)>c(CCl3COOH)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 通常状况下,48gO2和O3的混合气体中含有的氧原子数目约为3NA
B. 标准状况下,4.48 L甲醛(HCHO)含有的分子数目约为2NA
C. 1L1mol·L-1CH3CH2OH溶液中含有的氧原子数目约为NA
D. 1 molMg中含有的电子数目约为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用H2O2制取O2,下列说法不正确的是( )
A.H2O2分子中含有极性键和非极性键
B.H2O分子中只含极性键
C.H2O2分子中所有原子都达到8电子稳定结构
D.该反应中H2O2是氧化剂也是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种在生产和生活中应用广泛的金属元素。己知:
反应Ⅰ:Fe2O3(s)+ 3H2(g)=2Fe(s)+3H2O(g) ΔH1= +89 .6kJ /mol
反应Ⅱ:4Fe2O3(s)+Fe(s)=3Fe3O4(s) ΔH2=+2833.4kJ/mol
反应Ⅲ:Fe(s)+2HCl(g)![]() FeCl2(l)+H2(g) ΔH3
FeCl2(l)+H2(g) ΔH3
(1)反应Ⅰ的平衡常数表达式K=______________,该反应在高温下进行,最易生成的副产物是________________ (填化学式)。
(2)温度为T1时,恒容密闭容器中发生反应Ⅲ,反应时间与体系压强关系如图a所示,体系温度与HCl转化率关系如图b所示。
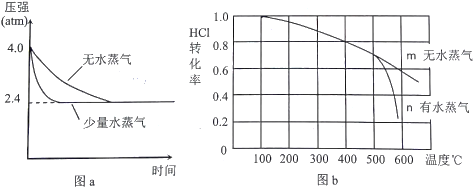
①分析图a,容器内通入少量水蒸气的作用是___________________。
②分析图b,ΔH3________0(填“>”、“<”或“=”),结合图a分析,T1=___________℃。
③分析图b,高于500℃后,曲线n发生的副反应热化学方程式为________________________________, 曲线n中HCl转化率明显降低的原因是____________________________________。
(3)①CaFeO4可制作半导体材料,向1L的高铁酸钠(Na2FeO4)溶液中加入0.0056g生石灰开始生成CaFeO4沉淀,原高铁酸钠溶液的物质的量浓度为________mol/L。已知Ksp(CaFeO4)=4.54×10-9,溶液体积变化忽略不计。
②用K2FeO4代替MnO2制备的碱性干电池(KOH做电解液)具有能量密度大、寿命长、无污染等优点,正极反应生成Fe2O3,写出正极的电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

A. 用装置甲制取一氯甲烷
B. 用装置乙在实验室制取氨气
C. 用装置丙萃取溴水中的溴
D. 用装置丁在实验室制蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中.从该废料中回收(CoO) 的工艺流程如图: 
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式 .
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 .
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是(填序号).
A.c(Na+)=2c(CO32﹣)
B.c(Na+)>c(CO32﹣)>c(HCO3﹣)
C.c(OH﹣)>c(HCO3﹣)>c(H+)
D.c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com