
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
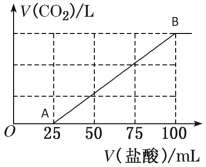
(1)A-B段的离子反应方程式为__________________________。
(2)原NaOH溶液的浓度为__________mol/L。
(3)通入CO2在标准状况下的体积为_______mL。
(4)所得溶液的溶质成分是_______________,其物质的量之比为_________。
【答案】H++HCO3-=H2O+CO2↑ 0.2 mol/L 336ml Na2CO3和NaHCO3 1:2
【解析】
向100mLNaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2═NaHCO3;AB段反应产生CO2气体,是由于发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,根据Na元素守恒,计算出溶液中NaOH的物质的量,结合c=![]() ,计算出NaOH的浓度;根据图像中发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗盐酸的物质的量,可计算出CO2的体积;利用Na2CO3与盐酸反应分步进行,首先是Na2CO3+HCl=NaHCO3+NaCl,然后是NaHCO3+HCl=CO2↑+NaCl+H2O,根据两步消耗盐酸的物质的量关系,结合图像中产生气体前后消耗HCl的体积多少判断溶液成分,并进一步计算各种成分的物质的量及其比值关系。
,计算出NaOH的浓度;根据图像中发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗盐酸的物质的量,可计算出CO2的体积;利用Na2CO3与盐酸反应分步进行,首先是Na2CO3+HCl=NaHCO3+NaCl,然后是NaHCO3+HCl=CO2↑+NaCl+H2O,根据两步消耗盐酸的物质的量关系,结合图像中产生气体前后消耗HCl的体积多少判断溶液成分,并进一步计算各种成分的物质的量及其比值关系。
(1)A-B段发生反应为NaHCO3+HCl=CO2↑+NaCl+H2O,其离子反应方程式为H++HCO3-=H2O+CO2↑;
(2)当产生气体达到最大值时,溶液为NaCl溶液,根据元素守恒,可得n(NaOH)=n(NaCl)=n(HCl)= 0.2 mol/L×0.1L=0.02mol,由于NaOH溶液的体积为100 mL,所以该溶液的浓度为c(NaOH)=![]() ;
;
(3)由图像可知发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗HCl体积为75mL,其物质的量是n(HCl)= 0.2 mol/L×0.075L=0.015mol,则n(CO2)= n(HCl)=0.015mol,V(CO2)= 0.015mol×22.4L/mol=0.336L=336mL;
(4) 向100mLNaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2═NaHCO3;溶液的成分可能有四种情况,分别是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3。若是第一种情况,不产生气体消耗HCl体积大于产生气体消耗HCl的体积,与图像不符合;若是第二种情况,不产生气体消耗HCl体积等于产生气体消耗HCl的体积,与图像不符合;若是第四种情况,加入盐酸立刻产生气体,也与图像不符合;只有第三种情况,不产生气体消耗HCl体积小于产生气体消耗HCl的体积,与图像符合。假如该溶液中Na2CO3和NaHCO3的物质的量分别为x、y,则根据图像可知25mLHCl发生反应Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)=n(HCl)=0.2mol/L×0.025L=0.005mol,75mL盐酸发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,则n(NaHCO3)(总)= 0.2 mol/L×0.075L=0.015mol,其中有0.005mol Na2CO3与HCl反应产生,所以原溶液中含有NaHCO3的物质的量为0.015mol-0.005mol=0.010mol,故所得溶液中n(Na2CO3):n(NaHCO3)=0.005mol:0.010mol=1:2。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是______(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:a.称取0.5000 g样品,放入盛有 20 mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;b.待样品溶解后,加水50 mL;c.立即用0.2000 mol·L-1 Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积; d.重复步骤a至c 2次,记录消耗标准溶液的平均体积为25.00 mL。
已知:CuCl + Fe3+ = Cu2+ + Fe2+ + Cl- Fe2+ + Ce4+ = Fe3+ + Ce3+
①配制100 mL 0.2000 mol·L-1 的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、100 mL容量瓶外,还需要_______。
②通过计算确定该样品中CuCl的纯度。______
③进行步骤c时若操作缓慢,则测得CuCl的纯度_______(“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如图所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
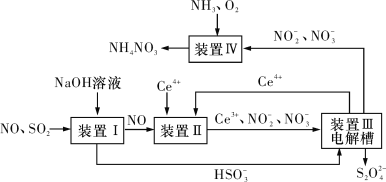
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是![]() 和
和![]() ,请写出生成等物质的量的
,请写出生成等物质的量的![]() 和
和![]() 时的离子方程式:__。
时的离子方程式:__。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的___(填“阳极”或“阴极”),同时在另一极生成![]() 的电极反应式为____。
的电极反应式为____。
(5)已知进入装置Ⅳ的溶液中![]() 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO![]() 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________(填字母代号)。
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是_______________,其物质的量之比是_______________
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___HNO3+_______→ _______+ _______ +___ NO↑+___H2O
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
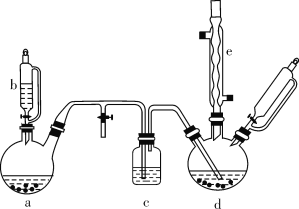
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,下列物质相互转化如图所示:

试回答:
(1)写出B的化学式________,D的化学式_________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中阳离子的试剂为__,写出发生反应的离子方程式____________。
(4)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式__________________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。( )
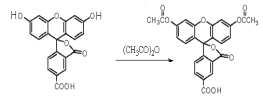
![]()
下列说法不正确的是 ( )
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,5-CFDA消耗的NaOH 物质的量多
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离的c( H+)= 1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42-
B. 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl-
C. ![]() =lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
=lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
D. 能与铝反应放出H2的溶液中:K+、Fe2+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com