
【题目】下列叙述正确的是
A.离子化合物中不可能含共价键
B.活泼金属与活泼非金属化合时能形成离子键
C.由非金属元素形成的化合物一定是共价化合物
D.共价化合物不可能含有离子键,熔融状态可以导电
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是

A. HR 的电离常数Ka=5×10-6
B. 图中X<7
C. a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D. b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请回答下列问题:
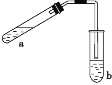
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,加入的操作顺序是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)写出实验中加热试管的目的:① ;② 。
(4)试管b中盛有饱和Na2CO3溶液,其作用是 。
(5)反应结束后,振荡试管b,静置,观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,①②③④分别是几种常见漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中哪一种最为匹配:A与_____________,B与______________,C与_______________,D与_______________。
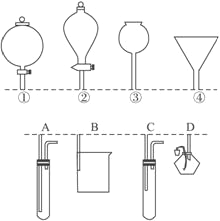
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若有A、B、C三种烃的衍生物,相互转化关系如下:
1,2二溴乙烷![]() 气体D
气体D![]() A
A![]() B
B![]() C
C
C跟石灰石反应产生使澄清石灰水变浑浊的气体。
(1)A、B、C中所含官能团的名称是 、 、 。
(2)书写下列反应的化学方程式
A→B的化学方程式为: ___________________
B→C的化学方程式为: ___________________
B→A的化学方程式为: ___________________
(3)上述A、B、C、D四种物质还原性最强的是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 20.0 g 质量分数为 14.0%的 KNO3溶液与 30.0 g 质量分数为 24.0%的 KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数_________。
(2)混合后溶液的物质的量浓度_______。
(3)在1000g水中需溶解______molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(4)标况下44.8LHCl溶于水配成500mL溶液。计算:
①HCl的物质的量____________________;
②所得溶液中溶质的物质的量浓度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com