
将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为: O2和CO2 ;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)= 0.16 mol和n(NaHCO3)= 0.02 mol;
第二种情况:n(Na2O2)= 0.02 mol和n(NaHCO3)= 0.09 mol.
| 有关混合物反应的计算;钠的重要化合物. . | |
| 专题: | 计算题. |
| 分析: | (1)根据反应后的溶液为中性可知,反应后溶质为NaCl,发生的反应为:2Na2O2+4HCl=4NaCl+2H2O+O2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,据此判断气体的组成情况; (2)第一份发生反应为:2Na2O2+4HCl=4NaCl+2H2O+O2↑、②NaHCO3+HCl=NaCl+H2O+CO2↑,生成气体为O2与CO2,将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量通过讨论的方法计算过氧化钠、碳酸氢钠的组成. |
| 解答: | 解:(1)Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,则反应后溶质为氯化钠,根据反应2Na2O2+4HCl=4NaCl+2H2O+O2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,2.24L混合气体为O2和CO2, 故答案为:O2和CO2; (2)2.24L混合气体的物质的量为: 2.016L气体的物质的量为: 2Na2O2+2CO2=2Na2CO3+O2 △n 2 2 1 n m 0.1mol﹣0.09mol=0.01mol 则:n=m=0.02mol, 第一种情况:若CO2完全反应,则第一份生成CO2的物质的量为:0.02mol,O2的物质的量为:0.1mol﹣0.02mol=0.08mol, 则:2Na2O2 +4HCl=4NaCl+2H2O+O2↑ 0.16mol 0.32mol 0.08mol NaHCO3 +HCl=NaCl+H2O+CO2↑ 0.02mol 0.02mol 0.02mol 所以Na2O2为0.16mol,NaHCO3为0.02mol; 第二种情况,若CO2未完全反应,则Na2O2的物质的量为:0.02 mol, 2Na2O2 +4HCl=4NaCl+2H2O+O2↑ 0.02mol 0.04mol 0.01mol 则第一份生成O2的为0.01mol, 所以CO2的物质的量为:0.1mol﹣0.01mol=0.09mol, NaHCO3 +HCl=NaCl+H2O+CO2↑ 0.09mol 0.09mol 0.09mol 所以Na2O2为0.02mol,NaHCO3为0.09mol, 故答案为:0.16;0.02;0.02mol;0.09. |
| 点评: | 本题考查混合物的计算,题目难度较大,关键讨论二氧化碳与过氧化钠过量反应,注意过氧化钠与盐酸的反应情况,试题培养了学生的分析、理解能力及化学计算能力. |


科目:高中化学 来源: 题型:
下列说法正确的是( )
A.糖类、油脂、蛋白质都能发生水解反应 B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物 D.油脂有油和脂肪之分,但都属于酯
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X是空气中含量最多的元素;Y、Z、W的最高价氧化物的水化物可以两两相互反应。
(1) R在周期表中的位置________;Z的原子结构示意图为_________。
(2) W原子的核外电子排布式是 ,在Z、W、R三原子中,未成对电子数最少的是 (填元素符号)
(3) W的氢化物A的分子构型为_____ __; 与W同主族且半径比W小的元素所形成的氢化物B,A的沸点比B的沸点 (填“高”或“低”),原因是
__; 与W同主族且半径比W小的元素所形成的氢化物B,A的沸点比B的沸点 (填“高”或“低”),原因是
(4) X的氢化物与其最高价氧化物的水化物等物质的量反应后,所生成的溶液中各离子浓度从大到小的顺序是
(5)Y、Z能够形成合金,且该合金中Y、Z的质量比为23:27,如果将含l mol Y的该合金置于足量水中充分反应,放出标况下气体________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒 C
(2)分离四氯化碳与水的混合物 E
(3)分离汽油和煤油 A
(4)分离碘水中的碘单质 B
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾 D .
查看答案和解析>>
科目:高中化学 来源: 题型:
分别设计实验,用最佳方法证明明矾溶于水发生的下列变化。
提供的药品和仪器有:明矾溶液、石蕊试液、酚酞试液、pH试纸、氢氧化钠溶液、酒精灯、聚光束仪。
(1)证明明矾发生了水解反应 。
(2)证明其水解反应是一个吸热反应 。
(3)证明生成了胶体溶液 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由硫可得多硫化钠Na2Sx,x值一般为2~6,已知Na2Sx与NaClO反应的化学方程式如下:
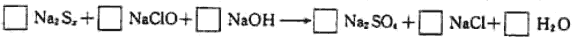 试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃) D.水 的电离是吸热的过程
的电离是吸热的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com