
用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒 C
(2)分离四氯化碳与水的混合物 E
(3)分离汽油和煤油 A
(4)分离碘水中的碘单质 B
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾 D .
| 物质的分离、提纯的基本方法选择与应用. . | |
| 专题: | 实验题. |
| 分析: | (1)不溶性固体与溶液常用过滤法分离; (2)对应分层的液体,利用分液法分离; (3)相互溶解的液体,沸点不同,利用蒸馏法分离; (4)碘在水中的溶解度小,在有机物中的溶解度大,可利用萃取法分离; (5)氯化钠的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,可利用重结晶法分离. |
| 解答: | 解:(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒,为不溶性固体与溶液的分离,则选择过滤,故答案为:C; (2)四氯化碳与水分层,则选择分液法分离,故答案为:E; (3)汽油和煤油相互溶解体,但沸点不同,则选择蒸馏法分离,故答案为:A; (4)碘在水中的溶解度小,在有机物中的溶解度大,分离碘水中的碘单质,则选择萃取法分离,故答案为:B; (5)氯化钠的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,所以提纯氯化钠和硝酸钾混合物中的硝酸钾,选择重结晶法分离,故答案为:D. |
| 点评: | 本题考查混合物的分离、提纯,明确常见混合物的分离方法及使用条件是解答本题的关键,题目难度不大. |


科目:高中化学 来源: 题型:
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是 ( )



|


|
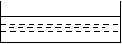 C、a为正极,是碳棒,烧杯中的溶液为硫酸
C、a为正极,是碳棒,烧杯中的溶液为硫酸
D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.除去Cu2+中的少量Fe3+,可加入CuO
B.沸点:晶体硅 > SiO2 > SiCl4 > NaCl
C.Cu(NH3)42+中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的
D.石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 小苏打溶液与稀硫酸混合:CO32﹣+2H+═CO2↑+H2O |
|
| B. | 石灰水与足量的碳酸氢钾溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O |
|
| C. | 大理石跟醋酸溶液反应:CaCO3+2CH3COOH═Ca2++2CH3COO﹣+H2O+CO2↑ |
|
| D. | 过氧化钠与水的反应:2O22﹣+2H2O═4OH﹣+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为: O2和CO2 ;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)= 0.16 mol和n(NaHCO3)= 0.02 mol;
第二种情况:n(Na2O2)= 0.02 mol和n(NaHCO3)= 0.09 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是 ( )
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12;
(1)写出Pb3O4与浓盐酸反应的化学方程式 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加
热分解后所得到的固体全部为Pb3O4,现将a mol PbO2加热分解,则加热过程中放出O2__________L(标准状况下);
(3)现将1 mol PbO2加热分解,收集产生的O2,加热分解后所得固体中,pb2+占Pb元
素的物质的量分数为x;再向加热所得固体中加入足量的浓盐酸,收集产生的C12,收集
到O2和C12的物质的量之和为y mol。
试回答下列问题:
①通过计算确定y与x的函数关系式。
②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为 ,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2A+2B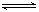 C+3D(各物质均为气体)在不同情况下测得有下列4 种反
C+3D(各物质均为气体)在不同情况下测得有下列4 种反
应速率,其中反应最快的是
A.v(A)=0.45 mol·L-1·s-1 B.v(B)=0.6 mol·L-1·s-1
C.v(C)=0.5 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com