
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 3.2×10-8 |
分析 (1)电解质溶液依据阴离子水解程度分析判断;依据碳酸氢钠不稳定性,受热容易分解生成碳酸钠和水的性质解答;
(2)水稀释过程中,越稀越水解;水的离子积是温度的函数;$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的分子降分母都乘氢氧根离子的浓度,得$\frac{{K}_{w}}{c(C{H}_{3}COOH)•c(O{H}^{-})}$;Kb=$\frac{c(O{H}^{-})•c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{1.8×1{0}^{-5}}$,由此分析解答.
解答 解:(1)阴离子对应的酸越弱水解程度越大,相同PH的溶液浓度越小,酸性强弱:CH3COOH>H2CO3>HClO>HCO3-,所以溶质的物质的量浓度由大到小的顺序是d>c>b>a,因为碳酸氢钠不稳定,受热容易分解生成碳酸钠和水,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,所以NaHCO3水溶液蒸干并灼烧,得到的物质是碳酸钠;故答案为:d>c>b>a;碳酸钠;
(2)水稀释过程中,越稀越水解,所以平衡正向移动;水的离子积是温度的函数,所以其溶液中c(H+)•c(OH-)将不变;$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的分子降分母都乘氢氧根离子的浓度,得$\frac{{K}_{w}}{c(C{H}_{3}COOH)•c(O{H}^{-})}$,而加水体积变大,所以醋酸的浓度和氢氧根离子的浓度都减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$将变大
;Kb=$\frac{c(O{H}^{-})•c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{1.8×1{0}^{-5}}$=$\frac{1{0}^{-9}}{1.8}$,故答案为:正向;不变;变大;$\frac{1{0}^{-9}}{1.8}$.
点评 本题考查了利用纯水显中性来求算水的离子积kw以及盐溶液“越弱越水解:的规律等知识点,题目难度中等,应注意酸或碱越弱,则对应的盐的水解程度越大的规律.


科目:高中化学 来源: 题型:解答题
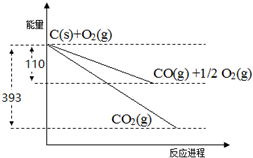 完成下列方程式
完成下列方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3可以做油漆的颜料 | B. | Al2O3可用作耐火材料 | ||
| C. | 铝合金比纯铝的熔点更高 | D. | 赤铁矿可用作炼铁的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g铝与足量的NaOH溶液反应转移的电子数目为0.2NA | |
| B. | 1L0.5mol/L的(NH4)2SO4溶液中含有的NH4+数目为NA | |
| C. | 2mol SO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| D. | 2.24L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇制丙烯;丙烯与溴水反应制1,2-二溴丙烷 | |
| B. | 溴乙烷水解制丙醇;丙烯与水反应制丙醇 | |
| C. | 甲苯硝化制对硝基甲苯;甲苯氧化制苯甲酸 | |
| D. | 乙酸和乙醇制乙酸乙酯;苯甲酸乙酯水解制苯甲酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜能导电,所以铜是电解质 | |
| B. | BaSO4难溶于水,所以BaSO4属于非电解质 | |
| C. | 虽然液态HCl不能导电,但HCl的水溶液能导电,所以HCl是电解质 | |
| D. | 氯气的水溶液能导电,氯气是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com