
 ������з���ʽ
������з���ʽ���� ��1�������Ȼ�ѧ����ʽ��д����д���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ䣻
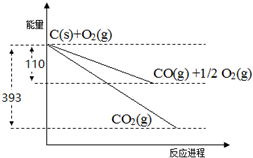
��2����ͼ1molC��������ȫ��Ӧ����1molCO2���壬�ų�����Ϊ��393KJ��������
����ͼ1molC��������ȫ��Ӧ����1molCO�����0.5mol���������ų�����Ϊ��110KJ���������Ȼ�ѧ����ʽC��s��+$\frac{1}{2}$O2��g��=CO��g����H=-110kJ/mol��
��3��CH4ȼ�ϵ���У�CH4�Ӹ���ͨ�룬�ڷ�Ӧ��ʧ���ӱ��������������������ɶ�����̼��ˮ��
��4����س��ʱ��������������Ӧ�����ϼ����ߣ��缫��ӦʽΪ��Fe2O3-6e-+10OH-=2FeO42-+5H2O��
��� �⣺��1����298K��101KPaʱ��1molH2��ȫȼ������Һ̬ˮ�ͷų�285.8KJ�����������ʾH2ȼ���ȵĻ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol��
�ʴ�Ϊ��2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol��
��2������ͼ1molC��������ȫ��Ӧ����1molCO2���壬�ų�����Ϊ��393KJ��������C��s��+O2��g��=CO2��g����H=-393KJ/mol���ʴ�Ϊ��C��s��+O2��g��=CO2��g����H=-393KJ/mol��
��C��s��+O2��g��=CO2��g����H=-393KJ/mol����C��s��+$\frac{1}{2}$O2��g��=CO��g����H=-110kJ/mol�����ɸ�˹���ɣ�2��-���֪��C��s��+CO2��g��=2CO��g������H=-110��2+393=+173KJ/mol���ʴ�Ϊ��C��s��+CO2��g��=2CO��g������H=+173KJ/mol��
��3����CH4ȼ�ϵ���У���������ȼ��CH4����ʧ���ӵ�������Ӧ�������Ի����£��缫��ӦΪ��CH4-8e-+2H2O=CO2+8H+���ܷ�ӦʽΪCH4+2O2=CO2+2H2O���ʴ�Ϊ��CH4-8e-+2H2O=CO2+8H+��
��4����س��ʱ��������������Ӧ�����ϼ����ߣ��缫��ӦʽΪ��Fe2O3-6e-+10OH-=2FeO42-+5H2O���ʴ�Ϊ��Fe2O3-6e-+10OH-=2FeO42-+5H2O��
���� ���⿼����CH4ȼ���ȵ��Ȼ�ѧ����ʽ��д����˹���ɵ�Ӧ�ã���Ҫ������ȼ�ϵ�صĵ缫����ʽ����д����Ŀ�ѶȲ���ע��������Һ������ԶԵ缫����ʽ��Ӱ�죮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2���ܺ�NaOH��Һ��Ӧ���ܺ�����ᷴӦ������������������ | |
| B�� | Һ������ʱҪ���մ������ȣ������������ | |
| C�� | �ܶ���������ǵĻ�����������ʱ����ʹ������ֳ��������ɫ�����ڻ�ѧ�Ͻ�����ɫ��Ӧ | |
| D�� | ��������������ͨ�뵽���Ը��������Һ�У���Һ��ɫ�������˶��������Ư���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 200mL1mol/LFe2��SO4��3��Һ�У�Fe3+��SO42-���������ܺ���NA | |
| B�� | 1 mol-CH3��1 mol OH-������10 NA������ | |
| C�� | ��״����3.36 L CCl4��̼ԭ����Ϊ0.15NA | |
| D�� | 1mol Na��ȫ��Ӧ����Na2O2ʱʧȥNA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������;�㷺�Ľ��������������������ײ����к��ĺ�����ҵ��ˮ��
������;�㷺�Ľ��������������������ײ����к��ĺ�����ҵ��ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�0.1mol•L-1Na2S��Һ�д��ڣ�c��OH-���Tc��H+��+c��HS-��+2c��H2S�� | |
| B�� | �����£�HA��Һ��0.1 mol•L-1NaOH��Һ������ȫ��Ӧʱ����Һ��һ�����ڣ�c��Na+���Tc��A-����c��OH-��=c��H+�� | |
| C�� | �����£���0.1 mol•L-1CH3COOH ��Һ��ˮϡ�ͣ�����Һ��pH��3.0����4.0ʱ����Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$��ֵ����ԭ����10�� | |
| D�� | �����£�pH=7��CH3COONa��CH3COOH�����Һ�У�c��Na+��=0.1 mol•L-1��c��Na+���Tc��CH3COOH����c��CH3COO-����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱij������Һ��pH��7���������һ���Ǽ��ǿ�������� | |
| B�� | ���ִ�����Һ�����ʵ���Ũ�ȷֱ�Ϊc1��c2��pH�ֱ�Ϊa��a+1����c1��10c2 | |
| C�� | ����amol/LNaX��Һ��bmol/LNaY����ϡ��Һ����a��b�����c��X-��=c��Y-�������Ƴ���Һ�е�c��HX����c��HY�� | |
| D�� | ��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��$\frac{{c��O{H^-}��}}{{c��N{H_3}•{H_2}O��}}$���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.8��10-5 | K1��4.3��10-7 K2��5.6��10-11 | 3.2��10-8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com