
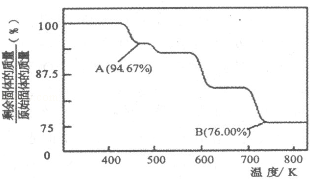
 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.分析 (1)①根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
②亚铁离子与Cr2O72-发生氧化还原反应,由c(Fe3+)和Ksp[Fe(OH)3]计算c(OH-),结合Ksp[Cr(OH)3]计算c(Cr3+);
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)①若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
②亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=4.0×10-12mol•L-1,则c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-14}}}$mol/L=1×10-8,溶液的pH=6;
该溶液中c(Cr3+)=$\frac{6.0×1{0}^{-31}}{({1×1{0}^{-8})}^{3}}$=6×10-7,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;6;6×10-7;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4;3;6;2;3;9H2O;
(3)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,
故答案为:Cr2O3.
点评 本题综合考查氧化还原反应的计算,涉及化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,题目难度中等,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题

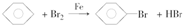 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | Fe3+、K+、Br-、SCN- | ||
| C. | NH4+、Na+、CO32-、OH- | D. | Al3+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | C=$\frac{1000a}{22.4V}$mol/L | |
| C. | 可用装置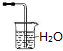 吸收氨气 吸收氨气 | |
| D. | 上述溶液中再加入VmL水,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 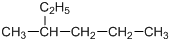 主链上的碳原子数是5 主链上的碳原子数是5 | B. |  名称是3甲基2丁烯 名称是3甲基2丁烯 | ||
| C. | 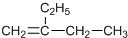 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | D. | 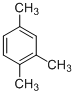 的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
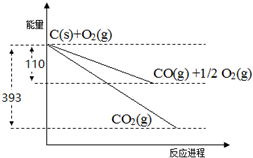 完成下列方程式
完成下列方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇制丙烯;丙烯与溴水反应制1,2-二溴丙烷 | |
| B. | 溴乙烷水解制丙醇;丙烯与水反应制丙醇 | |
| C. | 甲苯硝化制对硝基甲苯;甲苯氧化制苯甲酸 | |
| D. | 乙酸和乙醇制乙酸乙酯;苯甲酸乙酯水解制苯甲酸和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com