
A.1×10-7 mol·L-1
B.1×107 mol·L-1
C.0.1b/a mol·L-1
D.0.1b/(a+b) mol·L-1
科目:高中化学 来源: 题型:
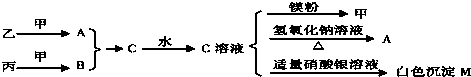
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省沈阳市高二上教学质量监测化学试卷(解析版) 题型:填空题
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)

(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系

①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有aA、bB、cC、dD、eE、fF六种短周期元素,原子序数依次增大,A、B、C、D都是生命不可缺少的重要元素。已知它们原子序数存在如下关系:a+b=c, a+c=d, b+c=f;元素A、B、C和D都能形成原子个数比为1:1和1:2的化合物;元素E的原子是短周期主族元素中原子半径最大的原子。其中由A、B、D三元素组成的化合物甲,其化学式灾BA4D;由D、E两元素形成原子个数比为1:1化合物乙;C的气态氢化物和最高价氧化物的水化物分别为丙和丁。请根据要求回答下列问题:
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式 。
(2)用甲和单质D2可设计成燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为 。
(3)3.9g乙与足量的水反应,电子转移的物质的量是 。
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是 。
(5)常温下向25mL 0.1mol?L―1丙溶液中逐滴滴加0.1mol?L―1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:

①图中m点由水电离也的OH―的物质的量浓度为 ;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各备种离子浓度由大到小的顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com