
【题目】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是
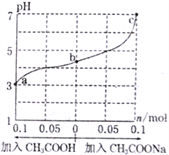
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
B. b点混合液中c(Na+)>c(CH3COO-)
C. 加入CH3COOH过程中, 增大
增大
D. 25℃时,CH3COOH的电离平衡常数Ka=![]()
【答案】D
【解析】分析:1.0L w molL-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加醋酸时,酸的量增多,使溶液酸性增强;加CH3COONa时,CH3COONa本身水解显碱性,相当于加碱,使溶液酸性减弱,最终达到中性。A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小;B.b点溶液pH<5,溶液显酸性,溶液中c(H+)>c(OH-),根据电荷守恒分析;C.醋酸存在电离平衡,其平衡常数表达式为Ka=![]() ,溶液中Kw=c(H+)c(OH),据此分析;D.pH=7时,溶液中c(H+)=c(OH-),醋酸的电离平衡常数为Ka=
,溶液中Kw=c(H+)c(OH),据此分析;D.pH=7时,溶液中c(H+)=c(OH-),醋酸的电离平衡常数为Ka=![]() ,根据电荷守恒分析计算。
,根据电荷守恒分析计算。
详解:1.0L w molL-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加醋酸时,酸的量增多,使溶液酸性增强;加CH3COONa时,CH3COONa本身水解显碱性,相当于加碱,使溶液酸性减弱,最终达到中性。A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,故A错误;B.b点溶液pH<5,溶液显酸性,溶液中c(H+)>c(OH-),溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故B错误;C.向混合液中加入CH3COOH固体,忽略溶液体积的变化,则溶液中c(Na+)不变,溶液中![]() =
=![]() ,因此溶液中
,因此溶液中![]() =
=![]() ,随着CH3COOH固体的不断加入,溶液中c(CH3COOH)不断增大,则该值减小,故C错误;D.pH=7时,溶液中c(H+)=c(OH-),溶液中存在电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于c(H+)=c(OH-),则此时溶液中c(Na+)=c(CH3COO-),根据图象,c(H+)=10-7molL-1,c(Na+)=c(CH3COO-)=0.2mol/L,则醋酸的电离平衡常数为Ka=
,随着CH3COOH固体的不断加入,溶液中c(CH3COOH)不断增大,则该值减小,故C错误;D.pH=7时,溶液中c(H+)=c(OH-),溶液中存在电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于c(H+)=c(OH-),则此时溶液中c(Na+)=c(CH3COO-),根据图象,c(H+)=10-7molL-1,c(Na+)=c(CH3COO-)=0.2mol/L,则醋酸的电离平衡常数为Ka=![]() =
=![]() mol/L,故D正确;故选D。
mol/L,故D正确;故选D。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的是( )
选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
A | 液氯 | 漂白粉 | Al2O3 | CO |
B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
C | 碱石灰 | 盐酸 | K2O | Cl2 |
D | 胆矾 | 水玻璃 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL 0.05mol/L Na2XO3恰好与20 mL 0.02 mol/LK2Cr2O7完全反应,已知K2Cr2O7中铬元素被还原为+3价,则X元素在氧化产物中的化合价为
A.+2B.+5C.+6D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为NA
B. 1molNaHSO4在熔融状态下电离出的阳离子数为2NA
C. 氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④钡的焰色反应为黄绿色
⑤没有铂丝时,也可以用玻璃棒代替
A.仅有③不正确B.仅有④不正确C.仅有⑤不正确D.全对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,下列有关四个曲线图的说法正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②可以表示相同pH的醋酸和盐酸分别加水稀释时溶液的pH随溶液体积的变化
C. 图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时的pH变化
D. 由图④可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
(2)装置2中的石墨是_______极(填“正”或“负”),该装置发生的总反应的离子方程式为_______。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的![]() 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为_____极;甲烧杯中铁电极的电极反应为_____;
结合平衡移动原理,说明甲烧杯中石墨电极附近溶液变红的原因_____。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com