
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】为证明溴乙烷中溴元素的存在,进行了一系列实验,试指出下列实验操作步骤的排列顺序中合理的是( )
①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④加蒸馏水 ⑤加入硝酸至溶液呈酸性 ⑥加入NaOH乙醇溶液
A. ②③⑤①B. ①②③④C. ④②⑤③D. ⑥③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A. 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D. Na2O2与CO2反应时,Na2O2既作氧化剂,又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是
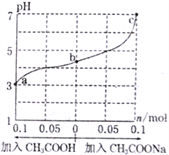
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
B. b点混合液中c(Na+)>c(CH3COO-)
C. 加入CH3COOH过程中, 增大
增大
D. 25℃时,CH3COOH的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因__________,如何判断其已洗涤干净_______。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是________。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→__________。

(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为__________________________。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O![]() 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。已知:Cr2O
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。已知:Cr2O![]() +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为____________。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是____。
③样品中无水三氯化铬的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ②④ B. ①③⑤ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。(碱石灰是氢氧化钠和氧化钙的混合物)

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是除去装置中的水蒸气和二氧化碳。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为____________________________、__________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________________________。
②E处干燥管中盛放的药品是________,其作用是________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L1硫酸、6 mol·L1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是______________,装置C的作用是______________,装置E的作用是_____________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com