
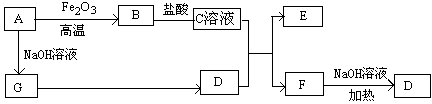
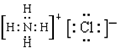
 Al(OH)3+3H+ ②c(Cl-) > c(NH4+) > c(H+)>c(OH-)
Al(OH)3+3H+ ②c(Cl-) > c(NH4+) > c(H+)>c(OH-)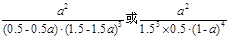
 NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O
NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+) > c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑; 2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)=" 5.4g÷27g/mol=0.2mol." 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3 n(Al)=3×0.2mol=0.6mol.n(酸)="0.2×2mol=0.4mol." n(H+)="a" n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2
Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+) > c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑; 2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)=" 5.4g÷27g/mol=0.2mol." 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3 n(Al)=3×0.2mol=0.6mol.n(酸)="0.2×2mol=0.4mol." n(H+)="a" n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2 2NH3。在反应方程式中V(H2):V(NH3)="3:2." V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)="2//3×1.2mol/(L·min)=0.8" mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2 mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K=
2NH3。在反应方程式中V(H2):V(NH3)="3:2." V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)="2//3×1.2mol/(L·min)=0.8" mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2 mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K=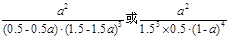 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
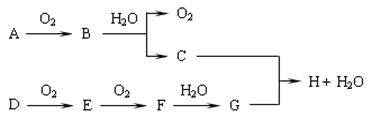
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

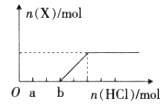
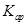 =2.5×
=2.5×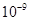 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·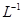 的BaCl2溶液中,其
的BaCl2溶液中,其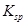 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·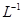 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )的说法正确的是
)的说法正确的是| A.质量数为46 | B.质子数为106 |
| C.电子数为46 | D.中子数为106 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 与
与 的核外电子数相等
的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com