
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
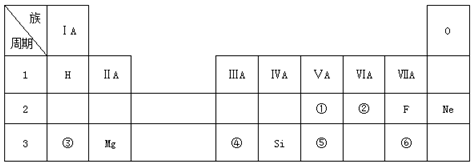
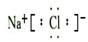 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是正极 | |
| C. | 电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气 | |
| D. | 铜锌原电池工作时,锌溶解,所以才产生电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧制氯化钠 | |
| B. | 二氧化锰和浓盐酸共热制氯气 | |
| C. | 氯气与消石灰反应制漂白粉 | |
| D. | 氢气、氯气混合光照后的产生溶于水制盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
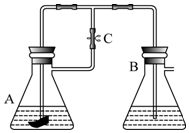 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英、水晶、玛瑙的主要成分都是单质硅 | |
| B. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | |
| C. | 实验室存放氢氧化钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | |
| D. | 二氧化硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com