
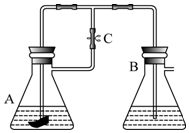
 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入. 分析 由实验装置可知,制备时先利用Fe与硫酸反应生成的氢气将空气排出,防止氢氧化亚铁被氧化,然后利用压强使硫酸亚铁与NaOH接触发生复分解反应,以此来解答.
解答 解:铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故A中加入的试剂是铁屑与稀H2SO4,在B中加入的试剂是氢氧化钠溶液,
打开止水夹C,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后检验A口排出气体的纯度,氢气纯时,说明空气排尽,然后关闭止水夹C,左侧气压升高,反应生成的Fe2+沿导管进入B中与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,这样生成的Fe(OH)2沉淀能较长时间保持白色,原因是A中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化,
故答案为:氢氧化钠溶液;A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
点评 本题考查制备实验的评价,为高频考点,把握物质的性质、制备原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积KW随温度、外加酸(碱)浓度的改变而改变 | |
| B. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达化学平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实现无氰电镀 | B. | 研制可降解塑料 | C. | 使用无铅汽油 | D. | 使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
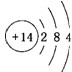
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com