
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

分析 (1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①依据平衡常数等于平衡生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
②根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)电池通入肼N2H4的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,依据生成的迁移体积计算物质的量得到氯化钠物质的量计算浓度,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.
解答 解:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1,则反应过程中放出的总热量应为234kJ,
故答案为:234kJ;
(2)①N2(g)+3H2(g)?2NH3(g)△H<0,平衡常数计算表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
②N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,
故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故答案为:c;
(3)①肼燃料电池中,在碱性条件下,N2H4失电子生成氮气与水,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224mL,由2Cl--2e-=Cl2↑可知,n(NaCl)=2n(Cl2)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L;
t1~t2电极反应式为:(阳极)4OH--4e-=O2↑+2H2O,t2点后电极反应式为:(阳极)4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为:4OH--4e-=O2↑+2H2O;t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极Cu2++2e-=Cu,所以t1~t2铁电极上的电极反应式为:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu; 0.1mol/L;
③t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=$\frac{0.112L×4}{22.4L}$=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液的pH=1,
故答案为:1.
点评 本题考查较为综合,涉及化学平衡的有关计算、电解池原理等知识点,题目难度较大,注意电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
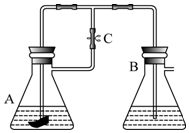 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO和CO2混合气体中含有碳原子树木为0.5NA | |
| B. | 常温常压下,71g氯气与足量氢氧化钠溶液反应转移的电子数为NA | |
| C. | 92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4LCl2完全溶于水中,溶液中n(Cl-)+n(ClO-)+n(HClO)<2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | Z |
| 单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的$\frac{2}{3}$ | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 简单离子半径:Z>W | |
| D. | 工业上用Y单质还原Z的氧化物得Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com