
| A. | 常温常压下,11.2LCO和CO2混合气体中含有碳原子树木为0.5NA | |
| B. | 常温常压下,71g氯气与足量氢氧化钠溶液反应转移的电子数为NA | |
| C. | 92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4LCl2完全溶于水中,溶液中n(Cl-)+n(ClO-)+n(HClO)<2NA |
分析 A、常温常压下气体摩尔体积大于22.4L/mol;
B、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
C、NO2和N2O4的最简式均为NO2;
D、氯气和水的反应为可逆反应,进行不彻底.
解答 解:A、常温常压下气体摩尔体积大于22.4L/mol,故11.2L混合气体的物质的量小于0.5mol,故含有的碳原子个数小于0.5NA个,故A错误;
B、71g氯气的物质的量为1mol,而氯气和碱的反应为歧化反应,故1mol氯气转移NA个电子,故B正确;
C、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为2mol,故含6NA个原子,故C正确;
D、氯气和水的反应为可逆反应,进行不彻底,故氯水中氯元素的存在形式有Cl-、HClO、Cl2、ClO-,故有N(Cl-)+N(ClO-)+N(HClO)+2N(Cl2)=2NA,故N(Cl-)+N(ClO-)+N(HClO)<2NA,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 水的离子积KW随温度、外加酸(碱)浓度的改变而改变 | |
| B. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达化学平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
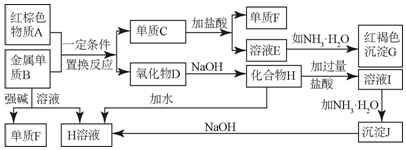
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
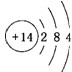 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅单既能与氢氧化钠反应又能与氢氟酸反应,所以硅具有两性 | |
| C. | 晶体硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方法 | 结论 |
| A | 实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 | 可以加快制备氢气的反应速率 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行 | 则该反应的△S<0 |
| D | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com