解答:
解:E是短周期元素中原子半径最大的元素,E应为Na元素;人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素,应为有机物,含有C、H元素,A与Na同一主族,则A为H元素、B为C元素;C的原子序数等于A、B的原子序数之和,则C的原子序数为:6+1=7,则C为N元素;D的原子序数等于A、C的原子序数之和,D的原子序数为:1+7=8,则D为O元素;F是一种生活中常用的金属,其原子序数大于11小于17,则F应为Al,
(1)B为C元素,原子序数为6,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期,ⅣA族,
故答案为:第二周期ⅣA族;
(2)F为Al,E的最高价氧化物对应水化物为NaOH,二者反应生成 偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
故答案为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑;
(3)非金属性越强,对应的气态氢化物越稳定,非金属性:O>N,则氢化物的稳定H
2O>NH
3;
同周期元素从左到右原子半径逐渐减小,则Na>Al,原子核外电子层数越多,半径越大,则有Na>Al>O,
故答案为:H
2O;NH
3;Na;Al;O;
(4)A、B、D分别为H、C、O,由两种或三种元素组成两种可以反应的阴离子,则对应的阴离子分别为HCO
3-、OH
-,二者反应的离子方程式为:HCO
3-+OH
-=H
2O+CO
32-,
故答案为:HCO
3-+OH
-=H
2O+CO
32-;
(5)A、B、D分别为H、C、O,由A、B、D三种元素按照原子个数比6:2:1,其实验式为C
2H
6O,由于H原子已经达到饱和,则该物质的分子式即为其实验式,该燃料电池为乙醇燃料电池,电解质为氢氧化钾溶液,则负极乙醇失去电子生成碳酸根离子和水,负极电极反应为:C
2H
6O+16OH
--12e
-=2CO
32-+11H
2O;
电解氯化钾溶液生成氢氧化钾、氯气和氢气,电解方程式为:2KCl+3H
2O
2KOH+H
2↑+Cl
2↑;
当理论上消耗112mL(标准状况)氧气时,氧气的物质的量为:
=0.005mol,转移的电子的物质的量为:0.05mol×4=0.02mol,根据电子守恒生成氢气的物质的量为:
=0.01mol,根据反应2KCl+3H
2O
2KOH+H
2↑+Cl
2↑可知,生成氢氧化钾的物质的量为0.02mol,氢氧化钾溶液的浓度为:
=0.1mol/L,则此时溶液的pH=13,
故答案为:C
2H
6O+16OH
--12e
-=2CO
32-+11H
2O;2KCl+3H
2O
2KOH+H
2↑+Cl
2↑;13;
(6)A、C、D、F分别为H、N、O、Al元素,F单质为金属铝,则N为氧化铝,通过电解氧化铝获得金属铝,加热Z获得氧化铝,则Z为氢氧化铝;
M为仅含非金属元素的盐,则M为硝酸铵,X、Y的溶液反应生成氢氧化铝沉淀和硝酸铵,反应的离子方程式为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;
N→F的反应为电解熔融氧化铝,反应的化学方程式为:2Al
2O
3(熔融)
4Al+3O
2↑;
常温下,为使0.1mol/L硝酸铵溶液中由硝酸铵电离的阴、阳离子浓度相等,根据电荷守恒可知,溶液中c(H
+)=c(OH
-),溶液显示中性,则应向溶液中加入一定量的氨水至溶液的pH=7,
故答案为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;2Al
2O
3(熔融)
4Al+3O
2↑;7.




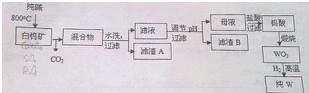
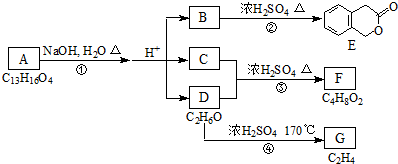
 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化: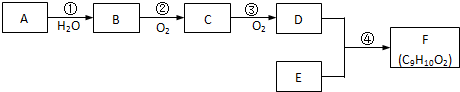
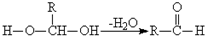
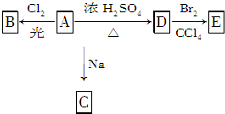
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答: