
| ||
| ||
| ||
| ||
| ||
| ||


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O |
| B、碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH -=CaCO3↓+2H2O+CO32- |
| C、苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O=C6H5OH+CO32- |
| D、稀硝酸与过量的铁屑反应 3Fe+8H++2 NO3-=3Fe 3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
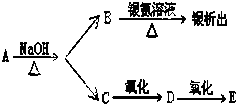 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 解释、结论 |
| ①取少量溶液于试管中,向其中滴加 | 溶液呈 | 说明此溶液阳离子是H+ |
| ②取少量溶液于另一个试管中,滴加 | 有不溶于稀硝酸的白色沉淀 | 说明此溶液的阴离子是,反应的化学方程式为 |
| 盐酸 |
| AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com