
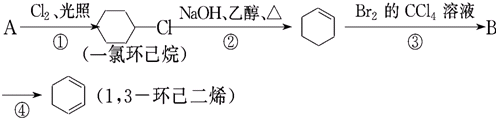
 ,反应①为取代反应,反应②为消去反应,反应③为C=C的加成反应,B为
,反应①为取代反应,反应②为消去反应,反应③为C=C的加成反应,B为 ,④为消去反应,以此来解答.
,④为消去反应,以此来解答. ,反应①为取代反应,反应②为消去反应,反应③为C=C的加成反应,B为
,反应①为取代反应,反应②为消去反应,反应③为C=C的加成反应,B为 ,④为消去反应;
,④为消去反应; +Cl2
+Cl2| 光照 |
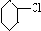 +HCl,故答案为:
+HCl,故答案为: +Cl2
+Cl2| 光照 |
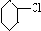 +HCl;
+HCl;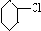 +NaOH
+NaOH| 乙醇 |
| △ |
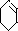 +NaCl+H2O,故答案为:
+NaCl+H2O,故答案为: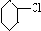 +NaOH
+NaOH| 乙醇 |
| △ |
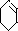 +NaCl+H2O;
+NaCl+H2O;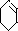 +Br2→
+Br2→ ,故答案为:
,故答案为: +Br2→
+Br2→ ;
; +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O,
+2NaBr+2H2O, +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O.
+2NaBr+2H2O.


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| A、①、③是置换反应,②是化合反应 |
| B、高温下,焦炭与氢气的还原性均弱于硅 |
| C、任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
| D、①中若碳不足量,生成的产物是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 常温下单质能与水剧烈反应生成氢气. | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
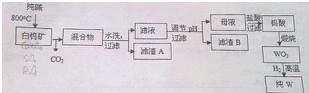
查看答案和解析>>
科目:高中化学 来源: 题型:
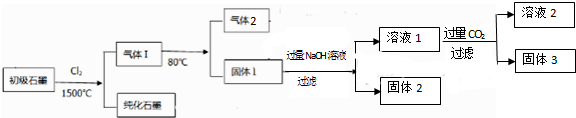
查看答案和解析>>
科目:高中化学 来源: 题型:
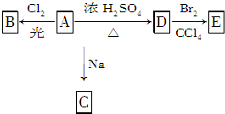 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com