
| A、Na2O2→Na |
| B、Al2O3→Al(OH)3 |
| C、SiO2→H2SiO3 |
| D、Fe(OH)2→Fe(OH)3 |


科目:高中化学 来源: 题型:
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极 |
| B、放电一段时间后,电解质溶液中KOH的物质的量改变 |
| C、在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 |
| D、放电时,通过甲烷的一极附近的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
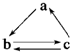 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
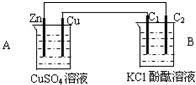 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和钢材的主要化学成分相同,性质也相同 |
| B、硬铝(Al-Cu-Mg-Mn-Si合金)制成的门窗耐酸、耐碱、耐高温腐蚀 |
| C、黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸 |
| D、铁矿石是一种可再生资源,没有必要进行开采限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、2:3 |
| C、1:4 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com