
��14�֣���Ҫ��ش��������⣺
��1��ʯī������C-C���ļ���Ϊ _____������ƽ��ÿ��������������Cԭ����Ϊ ����
��2�����ʯ�����к��й��ۼ��γɵ�Cԭ�ӻ���������С��C������ ��Cԭ�ӡ�
��3��CsCl������ÿ��Cs+��Χ�� ��Cl-��ÿ��Cs+��Χ��������Ҿ�����ȵ�Cs+���� ����
��4���������еļ���Ϊ �����ӵĿռ�ṹΪ ��ÿ��Pԭ������ ��Pԭ�ӽ�ϳɹ��ۼ�������1���Ӱ����е�����P-P����������һ����ԭ�ӣ����ɽ�� ����ԭ��, ��ÿ��Pԭ���ϵŶԵ���������ԭ����λ���Ϳ��Եõ�����һ�������� �������ʽ����
��5������������һ�� ���壬ÿ����ԭ����Χ�� ����ԭ�ӡ�
��6��������Ļ����ṹ��Ԫ������ԭ����ɵ�����ʮ�����ԭ�Ӿ��塣���к���20���ȱ������κ�һ����Ŀ�Ķ��ǣ�ÿ�����Ǹ���һ��ԭ�ӣ��Թ۲�ͼ�λش���������ṹ��Ԫ��_____����ԭ����ɣ�������________��B-B����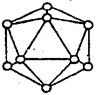

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
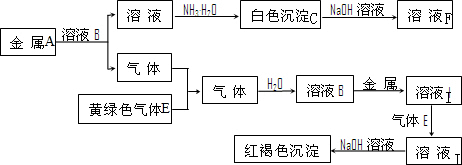
 A��B��C��D�����ɶ�����Ԫ����ɵij������ʣ�����A��B��C����ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����
A��B��C��D�����ɶ�����Ԫ����ɵij������ʣ�����A��B��C����ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����| ���� |
| �� |
| ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 H++CN-��H2O
H++CN-��H2O H++OH-��CN-+H2O
H++OH-��CN-+H2O HCN+OH-
HCN+OH- H++CN-��H2O
H++CN-��H2O H++OH-��CN-+H2O
H++OH-��CN-+H2O HCN+OH-
HCN+OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com