
【题目】以煤、天然气和生物质为原料制取有机化合物日益受到重视。E是两种含有碳碳双键的酯的混合物。相关物质的转化关系如图(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1)C中含氧官能团的名称_____;画出有机物D所含官能团的电子式:_____。
(2)A→B的反应类型为_____。
(3)C与D反应得到E的化学方程式_____。
(4)下列说法不正确的是_____。
A 有机物C和D都能和金属钠反应
B 在C和D生成E的反应中,浓硫酸有催化作用
C 可加入高锰酸钾将B氧化成C
D 可用新制Cu(OH)2鉴别B、C、D、E四种无色液体
【答案】羧基 ![]() 氧化反应 HOCH2CHOHCH2OH+CH2=CHCOOH
氧化反应 HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH
CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH(CH2OH)2+H2O C
CH2=CHCOOCH(CH2OH)2+H2O C
【解析】
(1)C为CH2=CHCOOH,C中含氧官能团的名称羧基;D为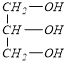 ,有机物D所含官能团的电子式为
,有机物D所含官能团的电子式为![]() ,
,
故答案为:羧基;![]() ;
;
(2)A为丙烯、B为丙烯醛,A发生氧化反应生成B,A→B的反应类型为氧化反应,
故答案为:氧化反应;
(3)C为羧酸,D为醇,二者发生酯化反应得到E,化学方程式为:HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH
CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH(CH2OH)2+H2O,
CH2=CHCOOCH(CH2OH)2+H2O,
故答案为:HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH
CH2=CHCOOCH2CHOHCH2OH+H2O或HOCH2CHOHCH2OH+CH2=CHCOOH![]() CH2=CHCOOCH(CH2OH)2+H2O;
CH2=CHCOOCH(CH2OH)2+H2O;
(4)A.C为CH2=CHCOOH,D为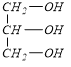 ,羧基和羟基都能和钠反应生成氢气,所以有机物C和D都能和金属钠反应,故正确;
,羧基和羟基都能和钠反应生成氢气,所以有机物C和D都能和金属钠反应,故正确;
B.在C和D生成E的反应中,该反应为酯化反应,浓硫酸作催化剂,所以浓硫酸有催化作用,故正确;
C.B中碳碳双键可被高锰酸钾溶液氧化,得不到丙烯酸,故错误;
D.B中醛基能和新制氢氧化铜悬浊液发生氧化反应生成砖红色沉淀、C和新制Cu(OH)2发生中和反应得到蓝色溶液,甘油和新制氢氧化铜反应得到绛蓝色溶液,E和新制氢氧化铜不反应,现象不同,可以鉴别,故正确;
故选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为( )
A.57B.47C.61D.293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们用下图所示实验,探究SO2及其水溶液的性质。下列说法正确的是
|
|
|
ⅰ. SO2溶于水 | ⅱ. 向ⅰ的水溶液中滴入品红溶液 | ⅲ.将ⅱ的溶液加热 |
A. ⅰ的溶液呈酸性,是由于SO2+H2O![]() H2SO3
H2SO3![]() 2H++SO32-
2H++SO32-
B. ⅱ中品红褪色,不足以证明具有漂白性的是SO2
C. ⅲ中溶液恢复红色,一定是H2SO3分解造成的
D. 上述实验涉及SO2的溶解性和强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
2HI(g)(正反应为放热反应)达到平衡后,下列说法不正确的是
A. 恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
B. 恒温时,减小容积平衡不移动,但气体颜色加深
C. 恒容时,通入H2,I2的质量分数减小
D. 恒压时,通入HI气体,刚开始时正反应速率会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A. 加催化剂,V正、V逆都发生变化,且变化的倍数相等
B. 加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数
C. 降温,V正、V逆都减小,且V正减小的倍数大于V逆减小的倍数
D. 增大氮气的浓度,V正、V逆都增大,且V正增大倍数大于V逆 增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=________。平衡时H2的转化率为________。
(2)平衡后,若要提高H2的转化率,可以采取的措施有________。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1________K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为________。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”、“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收akJ |
请回答:
①c1_____c2(填“>”、“<”或“=”);a=__________。
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是__________mol/(L·s)。
(2)压强为P1时,向体积为1L的密闭容器中充入bmol CO和2bmol H2,CO和氢气发生反应CO(g)+2H2(g)![]() CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:

①该反应属于__________(填“吸”或“放”)热反应;P1__________P2(填“>”、“<”或“=”)。
②100℃时,该反应的平衡常数K=__________(用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是__________(选填字母)。
2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是__________(选填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)![]() O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===== Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===== Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A. 戴维法制钠,阳极的电极反应式为:2OH-+2e-===H2↑+O2↑
B. 盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C. 若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D. 还可以用电解熔融氯化钠法制钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com