
| 实验事实 | 结论 | |
| A | 铁与硫单质生成FeS,与Cl2生成FeCl3 | 氧化性:Cl2>S |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) | 酸性:H2CO3>H2SiO3 |
| C | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| D | 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液一定有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.变价金属与氧化性强的氧化剂反应生成高价金属化合物;
B.发生强酸制取弱酸的反应;
C.发生燃烧反应生成MgO和C;
D.白色沉淀可能为AgCl或硫酸钡.
解答 解:A.Fe为变价金属,氯气的氧化性大于S的氧化性,则铁与硫单质生成FeS,与Cl2生成FeCl3,事实与结论均合理,故A正确;
B.将CO2通入Na2SiO3到溶液中产生白色沉淀(HSiO3),在溶液中发生强酸制取弱酸的反应,则酸性为H2CO3>H2SiO3,事实与结论均合理,故B正确;
C.将燃烧的镁条放入CO2中能继续燃烧生成MgO和C,Mg作还原剂,C为还原产物,则还原性为Mg>C,事实与结论均合理,故C正确;
D.白色沉淀可能为AgCl或硫酸钡,原溶液可能有SO42-或银离子,但二者不能同时存在,结论不合理,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、酸性比较及离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温下,在18g18O2中含有NA个氧原子 | |
| C. | 1 mol乙烷中含有C一H的键数为7×6.02×l023 mol-1 | |
| D. | 1mol-OH所含的电子数目为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

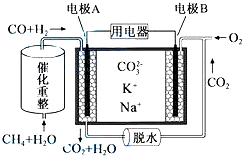
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 其分子式为C15H18O4 | |
| B. | 分子中含有2个手性碳原子 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com