
| A. | 改善性能,增大用途 | |
| B. | 除去硫、磷和过多的碳,调整合金元素的含量 | |
| C. | 副产磷肥、水泥等 | |
| D. | 用红棕色炉气制取水煤气 |
科目:高中化学 来源: 题型:选择题
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
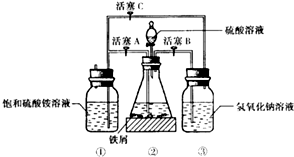
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
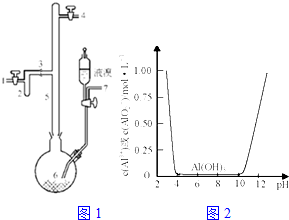 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
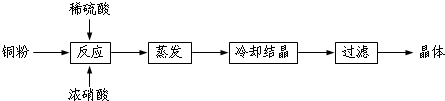
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
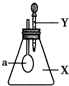 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )| X | Y | |
| A | NH3 | H2O |
| B | SO2 | NaOH溶液 |
| C | CO2 | 6mol•L-1 H2SO4溶液 |
| D | HCl | 6mol•L-1 Na2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com