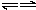(1)短周期非金属元素,其单质在常温下为气体有:H
2、N
2、O
2、F
2、Cl
2,根据题意,A、C两单质混合见光爆炸生成AC,混合见光爆炸是H
2和Cl
2的特征反应,结合原子序数依次递增,则可确定A是H元素,单质是H
2,C是Cl元素,单质是Cl
2.化合物AC为HCl.D与C
2和AC溶液反应分别得DC
3和DC
2,即D与Cl
2和HCl溶液反应分别得DCl
3和DCl
2,可分析出金属D化合价具有+2、+3价,确定出D为Fe元素.Fe的原子序数为26,则B的原子序数为13,即B为Al元素.C是Cl,Cl的原子序数=核电荷数=核外电子数=17,故原子示意图为
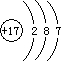
,B是Al,Al的原子序数=13,原子核外有3个电子层,最外层排布3个电子,根据电子层数=周期数,最外层电子数=主族序数,可得Al在周期表中位置为第三周期、第IIIA族,
故答案为:Cl

;第三周期第IIIA族;
(2)AC为化合物HCl,用电子式表示形成过程时,反应物用原子的电子式表示,生成物用化合物的电子式表示,符号用“→”符号,故表示为

,
故答案为:

;
(3)B单质是Al,根据铝的性质,与NaOH溶液反应时有水参与,生成偏铝酸钠和氢气,反应为Al+NaOH+H
2O→NaAlO
2+H
2↑,根据化合价升降法配平,Al由0价上升到+3价,上升3价,H
2中H由+1价降低为0价,总共降低2价,所以Al前面计量数为2,
H
2前面计量数为3,其它物质前计量数根据原子守恒配平即得方程式2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
改写离子方程式时Al、H
2是单质保留化学式,H
2O是弱电解质保留化学式,NaOH和NaAlO
2是易溶于水、易电离物质改成离子形式,再删除不参与离子反应的Na
+,
即得离子方程式2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑,故答案为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;
(4)根据题意,电解池的阳极材料为Fe,阴极材料为Al.金属作阳极时,电极称为活性电极,由于金属失电子能力强于溶液中的阳离子,所以阳极上是活性电极自身先失去电子.电解池的阳极放电顺序是:活性电极>Ag
+>Hg
2+>Fe
3+>Cu
2+>H
+等,因此阳极的另一个电极反应为Fe-2e
-=Fe
2+.生成的Fe
2+进入溶液中,溶液中Fe
2++2OH
-═Fe(OH)
2↓,来自水的电离H
2O
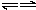
H
++OH
-,Fe(OH)
2易被氧气氧化,反应为4Fe(OH)
2+O
2+2H
2O═4Fe(OH)
3↓,上述三步反应合并即得总反应为4Fe
2++10H
2O+O
2=4Fe(OH)
3↓+8H
+.
故答案为:Fe-2e
-=Fe
2+;4Fe
2++10H
2O+O
2=4Fe(OH)
3↓+8H
+;
(5)根据题意,B单质是Al,D为Fe,2molAl与3molFe的氧化物反应为铝热反应,生成Fe和铝的氧化物,依据原子守恒,
2molAl生成1molAl
2O
3,1molAl
2O
3中共含有3mol氧原子,3mol氧原子只能来自于3molFe的氧化物中,因此Fe的氧化物中只含一个氧原子,
反应方程式为2Al+3FeO
Al
2O
3+3Fe,即D的氧化物W为FeO.
故答案为:FeO.