
| 1.2g |
| 0.01mol |
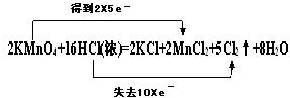 ,故答案为:
,故答案为: ;
;| 1.2g |
| 0.01mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、可能为升温 |
| B、平衡一定不移动 |
| C、H2 转化率增大 |
| D、HI平衡浓度一定变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、低温下为自发过程,高温下为非自发过程 |
| B、高温下为自发过程,低温下为非自发过程 |
| C、任何温度下为非自发过程 |
| D、任何温度下为自发过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
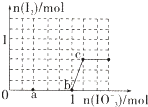 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A、还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B、a点处的氧化产物是SO42-,还原产物是I- |
| C、当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D、若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2,+5SO42-+3H++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、6a% |
| C、>3a% | D、<3a% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)
如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
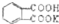 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:| 实验编号 | 邻苯二甲酸氢钾质量(g) | 待测NaOH溶液体积(mL) |
| l | 0.2040 | 23.20 |
| 2 | 0.2040 | 19.95 |
| 3 | 0.2040 | 20.05 |
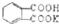 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com