
空气质量越来越爱到人们的关注,下表是部分城市某日的空气质量报告:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 北京 | 89 | NOx | Ⅱ | 良 |
| 上海 | 49 | — | Ⅰ | 优 |
| 宁波 | 55 | SO2 | Ⅱ | 良 |
| 克拉玛依 | 106 | PM10 | Ⅲ1 | 轻微污染 |
(1)由上表可知,在上述城市中,容易出现酸雨的城市有: ;空气质量最差的成都市是: 。
(2)可吸入颗粒(PM10)又称为飘尘,它与空气中的SO2、O2接触时,使部分的SO2转化为SO3,使空气酸度增加,形成酸雨。飘尘所起的主要作用是( )。
A.氧化剂 B.还原剂 C.吸附剂 D.催化剂
(3) 汽车排放的尾气、硝酸和化肥厂等工厂排出的废气中都含有氮氧化物,氮氧化物溶于水最终转化为 ,这也是造成酸雨的另一个主要原因。
(4) 酸雨可导致下列哪种危害( )
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.影响湖泊生态环境
(5) 根据上表,请你提出改善北京空气质量的一项建议。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、禁止使用四乙基铅作汽油抗爆震剂,可减少环境中的铅污染 | B、为防止富脂食品氧化变质,常在包装袋中放入生石灰 | C、铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大.人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性 | D、去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏.为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省德州市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法。
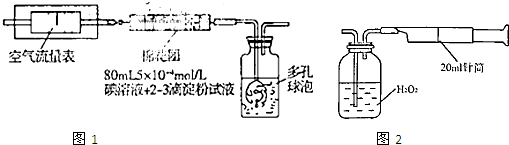
I.氧化还原法:甲同学拟采用下图所示的装置进行实验:
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2 g(精确到0.001),选择_______mL的容量瓶进行配制。该实验所涉及的氧化还原反应原理为 (用化学方程式表示),该实验原理是利用了SO2的 性。
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因 .
Ⅱ.重量法:乙同学拟用右图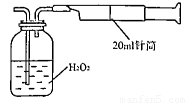 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
(3)取样处空气中SO2含量为 mg/L(精确到0.001)。
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行 .
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4
(5)请写出该电池负极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省凉山州高三第二次诊断性测试理综化学试卷(解析版) 题型:选择题
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下三种测定方法。
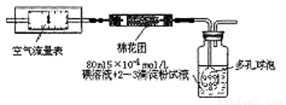
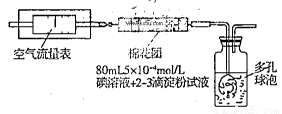
I.氧化还原法:甲同学根据化学反应原理SO2+I2+2H2O=H2SO4+2HI设计了如下图所示的装置进行实验:
(1)该实验需80ml浓度为5×10-4mol/L的碘
溶液,甲同学应选择 ml的容量瓶进行配制。
(2)广口瓶中使用多孔球泡的目的是 。
(3)在甲同学所配碘溶液浓度准确,并且量取药品及 实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因(至少写两种原因)
II.重量法:乙同学拟用实验室常用仪器组成简易装置测定空气中的SO2含量。实验操作过下:
按如下实验装置图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20ml的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀(H2SO4+BaCl2=BaSO4↓+2HCl),经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.18mg。
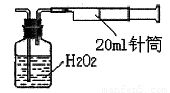
(4)取样处空气中SO2含量为 mg/L(精确到0.001)。
(5)现查阅资料知,常温下BaSO3的Ksp为5.48×10-7,饱和亚硫酸溶液中c(SO32-)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.lmol/L BaCl2溶液来吸收SO2即可产生沉淀,你认为这样做 (填“正确”或“不正确”),请利用以上数据简述理由 。
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4。
(6)请写出该电池负极的电极反应式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com