
【题目】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
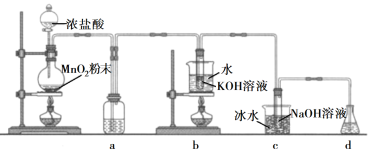
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是________________,采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,__________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
【答案】圆底烧瓶 饱和食盐水 水浴加热 Cl2+2OH=ClO+Cl+H2O 避免生成NaClO3 吸收尾气(Cl2) AC 过滤 少量(冷)水洗涤 紫 小于
【解析】
本实验目的是制备KClO3和NaClO,并探究其氧化还原性质;首先利用浓盐酸和MnO2粉末共热制取氯气,生成的氯气中混有HCl气体,可在装置a中盛放饱和食盐水中将HCl气体除去;之后氯气与KOH溶液在水浴加热的条件发生反应制备KClO3,再与NaOH溶液在冰水浴中反应制备NaClO;氯气有毒会污染空气,所以需要d装置吸收未反应的氯气。
(1)根据盛放MnO2粉末的仪器结构可知该仪器为圆底烧瓶;a中盛放饱和食盐水除去氯气中混有的HCl气体;
(2)根据装置图可知盛有KOH溶液的试管放在盛有水的大烧杯中加热,该加热方式为水浴加热;c中氯气在NaOH溶液中发生歧化反应生成氯化钠和次氯酸钠,结合元素守恒可得离子方程式为Cl2+2OHˉ=ClOˉ+Clˉ+H2O;根据氯气与KOH溶液的反应可知,加热条件下氯气可以和强碱溶液反应生成氯酸盐,所以冰水浴的目的是避免生成NaClO3;
(3)氯气有毒,所以d装置的作用是吸收尾气(Cl2);
A.Na2S可以将氯气还原成氯离子,可以吸收氯气,故A可选;
B.氯气在NaCl溶液中溶解度很小,无法吸收氯气,故B不可选;
C.氯气可以Ca(OH)2或浊液反应生成氯化钙和次氯酸钙,故C可选;
D.氯气与硫酸不反应,且硫酸溶液中存在大量氢离子会降低氯气的溶解度,故D不可选;
综上所述可选用试剂AC;
(4)b中试管为KClO3和KCl的混合溶液,KClO3的溶解度受温度影响更大,所以将试管b中混合溶液冷却结晶、过滤、少量(冷)水洗涤、干燥,得到KClO3晶体;
(5)1号试管溶液颜色不变,2号试管溶液变为棕色,说明1号试管中氯酸钾没有将碘离子氧化,2号试管中次氯酸钠将碘离子氧化成碘单质,即该条件下KClO3的氧化能力小于NaClO;碘单质更易溶于CCl4,所以加入CCl4振荡,静置后CCl4层显紫色。


科目:高中化学 来源: 题型:
【题目】二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
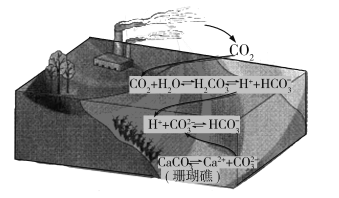
A.海水酸化能引起![]() 浓度增大、
浓度增大、![]() 浓度减小
浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.CO2能引起海水酸化,其原理为![]()
![]() H++
H++![]()
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是_____,第二周期原子半径由大到小的是______。
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是______,该分子为_____( 选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式_____,下列关于该元素和氧元素之间非金属性大小判断依据正确的是____(填编号)
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围______个NH3通过氢键相结合。
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3![]() +Cl2+H2O = 2
+Cl2+H2O = 2![]() +2
+2![]() +
+![]()
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:![]() +OH-=NH3·H2O
+OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+![]() +9H2,
+9H2,![]() 的结构如图所示:
的结构如图所示: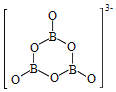 ;在该反应中,B原子的杂化轨道类型由______变为______。
;在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
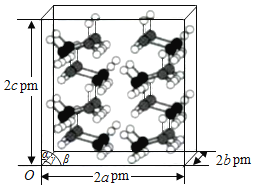
氨硼烷晶体的密度ρ=___________g·cm3(列出计算式,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构如下表
元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
【答案】 氮原子2p轨道半充满,能量低,稳定 否 F的电负性最大,只能得电子 2s22p5 2  能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】试题分析:R元素的基态原子最外层有3个未成对电子,次外层有2个电子,R是N元素;S元素的单质能与水剧烈反应,所得溶液呈弱酸性,S是F元素;T元素的基态原子3d轨道上有1个电子,T是21号元素Sc; X元素的原子核外有12个电子,X是Mg元素。
解析:根据以上分析,(1)R是N元素,氮原子2p轨道半充满,能量低,稳定,所以第一电离能要大于其同周期相邻的O元素。
(2)元素F的电负性最大,只能得电子,所以F元素没有正价;F元素的最外层电子排布式为2s22p5。
(3)Sc原子的核外电子排布式是1s22s22p63s23p63d14s2,所以N能层上电子数为2,其原子结构示意图为 。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
【题型】综合题
【结束】
20
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从硅的氧化物可以制取硅单质,主要化学反应如下:粗硅的制取:
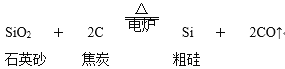
由粗硅制纯硅(常用方法):Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
根据以上反应,回答下列问题。
(1)在制取粗硅的反应中,焦炭的作用是什么___?
(2)在由粗硅制纯硅的反应中,氯气(Cl2)与Si的反应属于什么类型的反应___?SiCl4与H2的反应属于什么类型的反应___?H2的作用是什么___?
(3)在半导体工业中有这样一句行话:“从沙滩到用户”,你是如何理解的___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.丙烯的结构简式为CH2CHCH3
B.分子式为C4H10O属于醇类的有机物有4种
C.分子式为C2H4O2和C3H6O2的有机物一定互为同系物
D.![]() 名称为丙酸甲酯
名称为丙酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com