
【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
【答案】乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2 ④②①③ 检验是否有SO2 除去或吸收SO2 检验SO2 是否除尽 无水硫酸铜 水蒸气 ①③导出的气体带有水蒸气,影响水蒸气的确定 澄清的石灰水 CO2
【解析】
(1)浓硫酸有强氧化性,乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2 ;
(2)二氧化硫是否存在可用品红溶液检验,检验二氧化碳可以用澄清石灰水溶液,检验水用无水硫酸铜;操作步骤为应先检验水蒸气的存在,不能先通过澄清的石灰水来检验二氧化碳的存在,应先通过品红溶液褪色检验SO2的存在;
(3)通过酸性高锰酸钾溶液除去SO2,再通过品红溶液检验SO2是否除尽;
(4)检验水用无水硫酸铜,二氧化硫是否存在可用品红溶液检验,检验二氧化碳可以用澄清石灰水溶液,在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气。
(5)检验二氧化碳可以用澄清石灰水溶液。
(1)浓硫酸有强氧化性,乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2,
故答案为:乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2;
(2)二氧化硫是否存在可用品红溶液检验,检验二氧化碳可以用澄清石灰水溶液,检验水用无水硫酸铜;操作步骤为应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,二氧化碳的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在,再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用澄清石灰水实验检验二氧化碳;
故答案为:④②①③;
(3)二氧化硫是否存在可用品红溶液检验,二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,二氧化碳的检验应放在排除SO2的干扰后进行,先通过品红溶液褪色检验SO2的存在;再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净;
故答案为:检验是否有SO2;除去或吸收SO2;检验SO2 是否除尽;
(4)检验水用无水硫酸铜,白色变为蓝色说明含有水蒸气,验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,应最先用用无水硫酸铜检验水;
故答案为:无水硫酸铜;水蒸气;①③导出的气体带有水蒸气,影响水蒸气的确定;
(5)装置③中为澄清石灰水,用于检验二氧化碳的存在;
故答案为:澄清的石灰水;CO2。


科目:高中化学 来源: 题型:
【题目】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
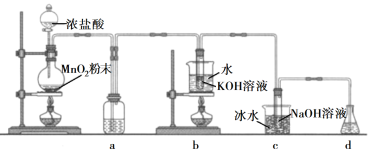
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是________________,采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,________,__________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究无机盐X(仅含三种元素,摩尔质量为270g·mol-1)的组成和性质,某学习小组进行了如下实验,其中气体单质A能使带火星的木条复燃。
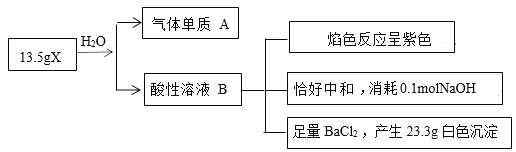
(1)X的组成元素为O和______(用元素符号表示)。
(2)写出X与水反应的化学反应方程式__________。
(3)X氧化能力极强,且对环境友好,可用于脱硫、脱硝。在碱性条件下,X氧化SO32-的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸的结构简式是:CH2![]() CHCOOH。试写出它与下列物质反应的方程式。
CHCOOH。试写出它与下列物质反应的方程式。
(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
(4)氢气________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
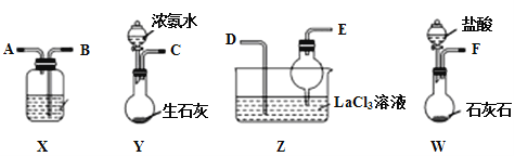
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l)C2H5OH(l) ΔH=-44.2kJ·mol-1;
2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1。
已知2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),其正反应的活化能为Ea kJ·mol1,则逆反应的活化能为__kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,其水解反应的离子方程式为__,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为__。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在三种不同催化剂作用下发生反应,相同时间内CO2的转化率随温度变化曲线如图所示:
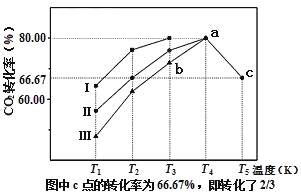
①催化剂效果最佳的反应是__(填“曲线I”,“曲线II”,“曲线III”)。
②b点,υ(正)__υ(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__。
④c点时该反应的平衡常数K=__。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
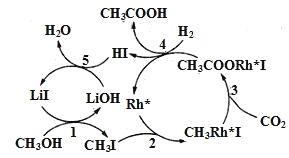
①根据图示,写出总反应的化学方程式:__。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
B.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO ![]() Mg
Mg
B.冶炼铝:铝土矿![]() NaAlO2
NaAlO2 ![]() 无水 AlCl3
无水 AlCl3![]() Al
Al
C.制硝酸: N2、H2![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3![]() 浓 HNO3
浓 HNO3
D.海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com