
【题目】科学家刚刚发现了某种元素的原子,其质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是
A. 该原子的摩尔质量是aNA g/mol B. Wg该原子的物质的量一定是W/(aNA)mol
C. Wg该原子中含有W/a个该原子 D. NA=12/a
科目:高中化学 来源: 题型:
【题目】有200mL MgCl2和 AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl﹣)=1.3mol/L,要使Mg2+全部转化为沉淀分离出来,至少需要2 mol/L NaOH 溶液的体积是( )
A. 40mL B. 72 mL C. 80 mL D. 160mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
(1)化学键断裂需要(填“释放”或“吸收”)能量;
(2)图中表示了吸收和释放的能量,其中释放的能量共kJ;
(3)该反应的反应物的总能量(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是(填“放热”或“吸热”)反应;
(4)用图示数据计算其反应热,写出该反应的热化学方程式 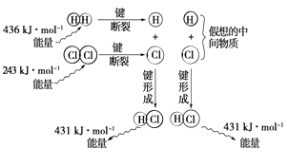
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.常温下,在 ![]() =1012的溶液中,Fe2+、I﹣、NO3﹣、Cl﹣一定不能大量共存
=1012的溶液中,Fe2+、I﹣、NO3﹣、Cl﹣一定不能大量共存
B.H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA﹣电离程度大于水解程度
C.使用催化剂一定能够降低化学反应的反应热(△H)
D.NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是
①液态水汽化
②浓硫酸稀释
③氯酸钾分解制氧气
④生石灰跟水反应生成熟石灰
⑤Ba(OH)2·8H2O与NH4Cl晶体混合
A. ①③B. ②④C. ④⑤D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃和101kPa时
①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣a kJ/mol
O2(g)═CO2(g)△H1=﹣a kJ/mol
②H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣b kJ/mol
O2(g)═H2O(l)△H2=﹣b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=﹣c kJ/mol
(1)试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H= .
(2)对反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是________
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
①上述条件下,前20秒二氧化氮的平均反应速率为 ,平衡时二氧化氮的转化率为 .
②该温度下,反应的平衡常数K值为 .(保留一位小数)
(4)甲醇﹣空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式 ,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为 .(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb , 则该氨水的电离度 α= .(请用c和Kb表示,可进行近似计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2混合气体3 g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为
A.1.5 g B.3 g C.6 g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是
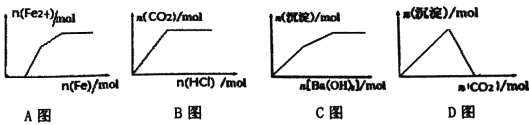
A. Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉
B. Na2CO3、NaHCO3溶液中逐滴加入HCl
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
D. NaAlO2溶液中逐渐通入CO2
【答案】A
【解析】A.Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉,铁粉先和稀硝酸完全反应生成Fe(NO3)3,继续加入铁粉,将溶液里的Fe(NO3)3全部还原为Fe(NO3)2,最后与Cu(NO3)2反应生成Cu和Fe(NO3)2,故A正确;B.Na2CO3、NaHCO3溶液中逐滴加入稀HCl,先与Na2CO3反应生成NaHCO3,完全反应后继续滴加稀盐酸,NaHCO3与稀HCl反应生成CO2气体,故B错误;C.假设n(KAl(SO4)2)=2mol,则n(Al3+)=2mol,n(SO42-)=4mol,当加入n(Ba(OH)2)=3mol时,Al3+完全沉淀生成2mol Al(OH)3,此时SO42-剩余1mol,继续加入1mol Ba(OH)2,此时发生的反应为Ba2++SO42-═BaSO4、Al(OH)3+OH-═AlO2-+2H2O,生成1molBaSO4沉淀,同时有2molAl(OH)3溶解,因此沉淀的物质的量减少,最后保持不变,根据分析可知图象应该只有一段上升的过程,故C错误;D.NaAlO2溶液中通入CO2,开始出现沉淀,当CO2过量时沉淀不溶解为定值,故D错误;故答案为A。
【题型】单选题
【结束】
16
【题目】下列实验中,对应的现象及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向FeSO4溶液中滴加HNO3酸化的H2O2 | 溶液由浅绿色变为黄色 | 氧化性: H2O2>Fe3+ |
B | 将铜粉加入lmol/LFe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 活泼性: Fe>Cu |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属熔化,液态铝不滴落下来 | 熔点: A12O3>A1 |
D | 向饱和NaHCO3溶液中滴加浓盐酸,再将产生的气体通入NaAlO2溶液 | NaAlO2 溶液变浑蚀 | 酸性: HCl>H2CO3>Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能增大相应化学反应速率的是( )
A. 盐酸和大理石反应制取CO2时,增加大理石的用量
B. Cu与稀硝酸反应制取NO时,改用浓硝酸
C. NH4Cl与熟石灰反应制NH3时,增大压强
D. 在用Zn和稀硫酸反应制氢气时,加入几滴硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com