
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。

(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
【答案】 3s a 0.03mol/(L·s) 2:1 70%
【解析】试题分析:(1)达到平衡状态时,体系中反应物、生成物浓度不再改变;
(2)反应中NO2的浓度增大;(3)根据![]() ,计算用NO表示从0~2s内该反应的平均速率;
,计算用NO表示从0~2s内该反应的平均速率;
(4)v(NO):v(O2)=系数比;
(5) O2的转化率=![]() 。
。
解析:(1)达到平衡状态时,体系中反应物、生成物浓度不再改变,3s后c(NO)不再变化,达到平衡状态所需时间是3s;
(2)反应中NO2的浓度增大,表示NO2的浓度变化曲线是a;
(3)根据![]() ,用NO表示从0~2s内该反应的平均速率v=
,用NO表示从0~2s内该反应的平均速率v=![]() 0.03mol/(L·s);
0.03mol/(L·s);
(4)v(NO):v(O2)= 2:1
(5) O2的转化率=![]() =
=![]() 70%。
70%。


科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成 ![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中最终肯定是白色沉淀的是( )
A. 单质钠投入 MgCl2溶液 B. AlCl3溶液中加入过量KOH溶液
C. FeCl2溶液中加入过量氨水 D. Fe2(SO4)3溶液中加入过量KOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H10O且属于醇类的同分异构体有x种(不包括立体异构,下同),分子式为C5H10O且属于醛类的有机物的同分异构体有y种,则 x和y的关系为( )
A. x=yB. x>yC. x<yD. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ka=1.77×104 | Ka=4.9×1010 | Ka1=4.3×107 Ka2=5.6×1011 |
下列选项正确的是
A.NaCN溶液中通入少量CO2气体:c(Na+) > c(![]() ) >c(
) >c(![]() )
)
B.稀释等体积、等浓度的HCOOH和HCN至相同pH,加水的体积前者小于后者
C.物质的量浓度相等的HCOONa和KCN溶液中:c(Na+)c(HCOO) >c(K+)c(CN)
D.等体积、等浓度的HCOOH和NaCN混合溶液中:c(H+)+c(HCN) =c(HCOO)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。
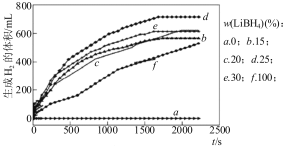

甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:


定性分析:(1)如图甲所示可通过观察____________________,定性比较得出结论.
(2)有同学提出试剂的选择不妥,应将FeCl3改为更为_____________合理。
(3)H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:___________________________,若第一步反应慢第二步反应快,则总反应速率由_____________(填“第一步”或“ 第二步”)决定。
定量分析:(4)如图乙所示,以实验时均生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 可利用厨房中的食醋除去热水瓶水垢中的CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
B. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
C. 往NH4HCO3溶液中加过量的NaOH溶液并加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 金属钠和水反应:Na+H2O=Na++OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com