
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
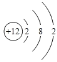
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
【答案】具体位置如下:
 三 ⅢA 二 ⅥA S2->Cl- HClO4 SO2、SO3 2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑) Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)
三 ⅢA 二 ⅥA S2->Cl- HClO4 SO2、SO3 2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑) Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)
【解析】
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,铍的原子半径为0.089nm,E的原子半径小于铍且其最低负价是-2,元素的最低负价=其最外层电子数-8,所以E位于第VIA族,为O元素,这几种元素都是短周期元素,原子半径大小顺序是A>B>C>D,这几种元素的原子半径都大于铍原子,则为第三周期元素,结合其主要化合价知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素,据此分析作答。
根据上述分析可知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素、E为O元素。
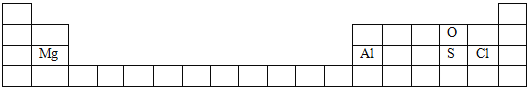
(1)O元素位于第二周期第VIA族、Mg元素位于第三周期第IIA族、Al元素位于第三周期第IIIA族、S元素位于第三周期第VIA族、Cl元素位于第三周期第VIIA族,所以其在周期表中的位置为 ,
,
(2)A为Mg元素,其核电荷数为12,原子的结构示意图为: ;
;
(3)B元素原子核外电子层数等于其周期数,其最外层电子数等于其族序数,Al原子核外有3个电子层,最外层有3个电子,所以铝元素位于第三周期IIIA族;
(4)E为O元素,位于元素周期表第二周期ⅥA族;
(5)S2-和Cl-核外电子数均为18,因电子层数相同的微粒,核电荷数越大半径越小,则简单离子半径比较:S2->Cl-;
(6)最高价氧化物对应水化物分别为Mg(OH)2、Al(OH)3、H2SO4、HClO4,元素的非金属性越强,其最高价氧化物的水化物的酸性越强,但O元素没有正化合价,其次非金属性强的是Cl元素,所以酸性最强的酸是HClO4,
故答案为:HClO4;
(7)c为硫,E为氧,二者可以形成二氧化硫、三氧化硫,化学式:SO2、SO3,故答案为:SO2、SO3;
(8)Al单质和氢氧化钠溶液反应会生成四羟基合铝(或偏铝酸钠)与氢气,方程式为:2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑);
B的最高价氧化物对应水化物为氢氧化铝,它和氢氧化钠溶液反应的离子方程式为:Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)。


科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
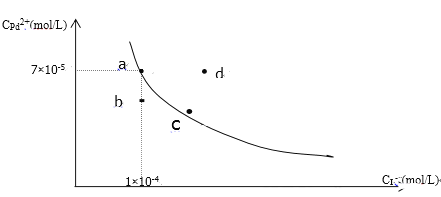
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应:
①A+H2O―→B+C ②C + F―→D
③D+NaOH![]() F+E+H2O
F+E+H2O
(1)写出它们的化学式:
C________,D________,E________。
(2)写出各步反应的离子方程式:
①_______________________________________________________________;
③_______________________________________________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O。写出该步反应的化学方程式:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的溶质质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为![]()
B.物质的量浓度c可表示为![]()
C.溶液的质量分数w%可表示为![]()
D.相对分子质量Mr可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F6种短周期元素,G为过渡元素;已知相邻的A、B、C、D 4种元素原子核外共有56个电子,在周期表中的位置如图所示。1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E单质粉末与G的氧化物常用于野外焊接钢轨;F是短周期最活泼的金属元素。请回答下列问题:
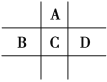
(1)元素D、G的名称分别为:__。
(2)D的单质与C的气态氢化物反应方程式为___。
(3)C、E、A的简单离子半径:__>__>__,B、C、D的最高价氧化物对应的水化物的酸性强弱顺序为___(用化学式表示)。
(4)向D与E形成的化合物的水溶液中滴加过量烧碱溶液的离子方程式为__。
(5)用电子式表示F与C形成化合物的过程___。
(6)G的单质与高温水蒸气反应的方程式___。
(7)部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是___。
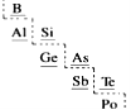
A.B只能得电子,不能失电子 B.原子半径Ge>Si
C.As可作半导体材料 D.Po处于第六周期第VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
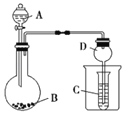
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
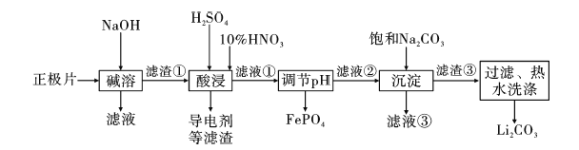
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气电池的电容量大,可作为汽车的清洁能源。总反应式为:2Zn+O2+2H2O=2Zn(OH)2。示意图如图所示:
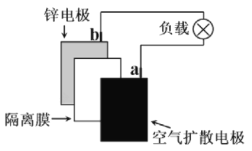
有关该电池的说法正确的是( )
A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2+2H2O+4e-=4OH-
D.阻隔空气进入锌--空气电池,电池停止工作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com