
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:

已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:填空题
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:

(1)E的大小对该反应的反应热________影响?(填“有或无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高或降低”);
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率υ(SO2)为0.05 mol/(L·min),则υ(O2)=___________mol/(L·min);
(4)1 mol SO2(g)氧化为1 mol SO3(g)的反应热ΔH1___________1 mol SO2(g)氧化为1 mol SO3(l)的反应热ΔH2。(填“>、<或=”)
(5)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017年黑龙江佳木斯一中高一上9.10周练化学卷(解析版) 题型:选择题
在相同的温度和压强下,二氧化碳和笑气(化学式为N2O)的体积相同,则下列一定相同的是( )
(1)分子数 (2)原子数 (3)密度 (4)质量 (5)物质的量
A.只有(1)(5)
B.只有(1)(2)(4)(5)
C.只有(2)(3)(4)(5)
D.(1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
已知反应:2NO2 (g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,
N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管, 把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )

A.上述过程中,A烧瓶内正、逆反应速率均加快
B.上述过程中, B烧瓶内c(NO2)减小,c(N2O4)增大
B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g) N2O4(g)的逆反应为放热反应
N2O4(g)的逆反应为放热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
100mL浓度为2mol•L﹣1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol•L﹣1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
某混合物含有氯化钠、碳酸钠和氯化钾。经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为
A. 20% B.30% C.45% D.55%
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
A.一定有碘离子 B.可能含铁离子 C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:实验题
下列实验步骤是兴趣小组对某混合样品含量的测定,样品成分为FeO、FeS2、SiO2、及其它杂质,杂质不与酸碱反应,受热稳定。(步骤中所加试剂均为足量)
①称量mg样品灼烧。装置如下:
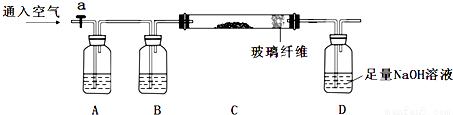
②D瓶溶液
 固体(ag)
固体(ag)
③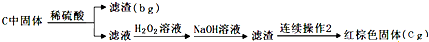
请回答下列问题:
(1)连接好仪器后,如何检查整套装置的气密性_______________。
(2)A瓶内所盛试剂是__________溶液。灼烧完成后熄灭酒精灯,若立即停止通空气,可能对实验的影响是(写两点) _________________________。
(3)步骤②中加入双氧水的离子方程式为____________________。若此步骤不加入双氧水对测定硫元素含量的影响是_____________(填“偏高”、“偏低”或“无影响”)。
(4)连续操作1为_________、洗涤、_________、称量;连续操作2为洗涤、_________、称量。
(5)从步骤③的bg滤渣入手,可测定SiO2的含量,下面各组试剂中不适合测定的是___________。
A.NaOH溶液 、稀硫酸 B.Ba(OH)2溶液、盐酸 C.氨水、稀硫酸 D.NaOH溶液、盐酸
(6)求样品中FeO的质量分数(列出算式即可)____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com