
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:

(1)E的大小对该反应的反应热________影响?(填“有或无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高或降低”);
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率υ(SO2)为0.05 mol/(L·min),则υ(O2)=___________mol/(L·min);
(4)1 mol SO2(g)氧化为1 mol SO3(g)的反应热ΔH1___________1 mol SO2(g)氧化为1 mol SO3(l)的反应热ΔH2。(填“>、<或=”)
(5)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=____________。
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:选择题
2.0mol的PCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)  PCl5(g)。达平衡时,PCl5为0.40mol;如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量为
PCl5(g)。达平衡时,PCl5为0.40mol;如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量为
A. 0.40mol B. 0.20mol C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:选择题
下列各离子方程式中,属于水解反应且书写正确的是( )
A.CH3COOH+H2O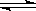 H3O++CH3COO- B.CO32-+2H2O
H3O++CH3COO- B.CO32-+2H2O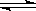 H2CO3+2OH-
H2CO3+2OH-
C.HCO3-+H2O 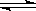 H3O++ CO32- D.HS-+H2O
H3O++ CO32- D.HS-+H2O 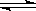 H2S+OH-
H2S+OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:选择题
已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:选择题
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:实验题
己知:KI溶液在酸性条件下能被空气中的O2氧化。
(1)写出发生反应的离子方程式_______________________。
(2)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成下表中①和②的内容。
(限选试剂:0.1 L mol/L硫酸、0.2 mol/L硫酸、1 mol/L KOH溶液、淀粉溶液)
组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
c(KI) | Υ | c(H2SO4) | Υ | ||||
1 | 298K | 1 mol/L | 5 mL | 0.1mol/L | 5 mL | 3滴 | l组和2组探究②__________对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
2 | 308K | 1 mol/L | 5 mL | 0.1mol/L | 5 mL | 3滴 | |
3 | 298K | 1 mol/L | 5 mL | ①___________ | 5 mL | 3滴 | |
(3)在上述实验中,三种溶液混合的顺序最合理的是_______(选填下列选项);应记录的是_________所需的时间。
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加 入淀粉溶液
入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用υA、υB、υC表示,已知2υB =3υA、3υC=2υB,
则此反应可表示为( )
A.A+3B=2C B.2A+3B=2C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源:2016-2017年黑龙江佳木斯一中高一上9.10周练化学卷(解析版) 题型:填空题
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏伽德罗常数用NA表示,则
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:实验题
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:

已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com