
【题目】锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性。
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:

①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为:
___________________________________________________________________________
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)= _________________________。
③往1L1.00 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol。
④已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是____________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50 mol·L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
①在25℃下,将a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=___________mol L—1。
②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____________(填字母)。
a.此溶液一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—)
b.此溶液一定有c(Cl-) = c (NH3·H2O) +c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
【答案】 Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑ 10-17(mol L—1)3 1. 80 CD ![]() bc
bc
【解析】试题分析:(1)①锌和铝的性质具有一定的相似性,根据铝与氢氧化钠的反应分析;②根据a点坐标数值计算Zn(OH)2的溶度积;③根据氢氧化锌的溶度积,可计算pH=6时锌离子浓度,再计算消耗NaOH的物质的量;④由表中数据可知,当Cl-浓度由小变大时,PbCl2的溶解度会先变小后变大,说明当Cl-增加到一定浓度时,PbCl2可以与Cl-形成某种离子(如配合物)而增大溶解度;(2)①a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,根据电荷守恒、物料守恒计算![]() 、
、![]() 、
、![]() ;②根据根据电荷守恒、物料守恒分析。
;②根据根据电荷守恒、物料守恒分析。
解析:(1)①锌和铝的性质具有一定的相似性,所以锌与氢氧化钠反应生成四羟基和锌酸钠与氢气,离子方程式为Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑;②根据a点坐标数值, ![]() =
=![]() 、
、![]() ,则Zn(OH)2的溶度积=
,则Zn(OH)2的溶度积=![]() 10-17(mol L—1)3 ;③根据氢氧化锌的溶度积, pH=6时锌离子浓度
10-17(mol L—1)3 ;③根据氢氧化锌的溶度积, pH=6时锌离子浓度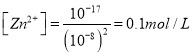 ,消耗锌离子0.9mol, NaOH的物质的量1.8mol。④根据表格数据,随着盐酸浓度的增大,PbCl2固体的溶解度增大,故A错误;
,消耗锌离子0.9mol, NaOH的物质的量1.8mol。④根据表格数据,随着盐酸浓度的增大,PbCl2固体的溶解度增大,故A错误;
溶度积只与温度有关,PbCl2固体在0.50 mol·L-1盐酸中的Ksp等于在纯水中的Ksp,故B错误;
PbCl2能与浓盐酸反应生成一种难电离的阴离子![]() ,故C正确;
,故C正确;
饱和食盐水中含有高浓度的氯离子,所以PbCl2固体可溶,故D正确。
(2)①a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,根据电荷守恒![]() +
+![]() =
=![]() ;根据物料守恒计算
;根据物料守恒计算![]() +
+![]() =
= ![]() ;
; ![]() =
= ![]() ;所以
;所以![]() =
=![]()
![]() 、
、![]() =
= ![]() 、
、![]() =
= ![]() ;NH4+的水解常数Kh=
;NH4+的水解常数Kh=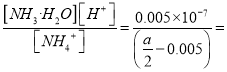
![]() ;②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性;
;②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性;
根据电荷守恒,一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—),故a正确;
b.溶液呈碱性,溶液一定有c(Cl-) <c(NH4+)故b错误;
c.溶液呈碱性,说明氨水电离程度大于氯化铵的水解程度,水的电离程度一定小于该温度下纯水的电离程度,故c错误;
d.氯化铵与氢氧化钠反应生成弱碱,盐酸与氨水反应生成氯化铵,所以此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大,故d正确;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】
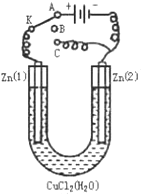
(1)如果把开关K接A,该装置应是 ,Zn(2)极是 极,电极反应式为 。
(2)上述反应进行5min后,置换开关K到C,则该装置是 ,Zn(2)极是 极,电极反应式是 。
(3)上述装置进行2min后,再置换开关K至B,则Zn(1)极发生的化学反应方程式为 ,Zn(2)极发生的有关电化学的反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液②是胶体
③能产生丁达尔效应④能透过滤纸
⑤不能透过滤纸⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确使用药物,可以促进身心健康。人体牙龈出血、患坏血病主要是缺乏________;小苏打可治疗胃酸过多,写出小苏打与胃酸(HCl)反应的离子方程式:
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是
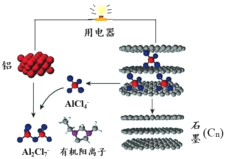
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e- + 7AlCl4– = 4Al2Cl7–
D.充电时的阳极反应为:Cn + AlCl4––e- = CnAlCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃1体积只能与1体积Cl2发生加成反应,生成氯代烷烃。此氯代烷烃1mol可与4molCl2发生完全取代反应,则该烃的结构简式为
A. CH2=CH2 B. CH3CH=CH2 C. CH3CH3 D. CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁橄榄石是天然的铁矿石,可以通过如下反应和相应的数据推知它的化学式。其中A~J是中学化学中的常见物质,G是一种红褐色固体,D是一种难溶于水的含氧酸,J是一种主要的温室气体,A的焰色反应呈黄色,E和B分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生。由实验测得铁橄榄石的摩尔质量为204g ·mol-1,其中铁元素的质量分数为54.9%,流程中的部分生成物已略去。

回答下列问题:
(1)A的电子式_____________。
(2)铁橄榄石的化学式_____________。
(3)写出C→F的离子方程式_____________。
(4)写出H→G的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com