
 ��
�� �������������ˮ����ķ���ʽH3PO4��
�������������ˮ����ķ���ʽH3PO4�� ��
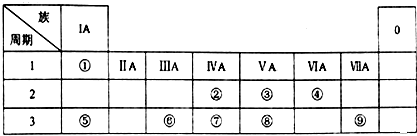
������ ��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪP����Ϊ Cl��
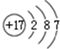
��1����Ϊ Cl��ԭ�Ӻ��������Ϊ17�����������Ϊ2��8��7��
��2����ΪC����̬�⻯��ΪCH4����ΪP������������ˮ����ķ���ʽΪH3PO4��
��3���ڡ��۷ֱ�ΪC��N���ǽ�����Խǿ������������Ӧˮ���������Խǿ��
��4���ݡ���Ԫ�طֱ�ΪNa��Al��ͬ���ڴ����ҽ����Լ�����
��5�����Ӳ���Խ�࣬�뾶Խ����ͬ���Ӳ�����ԭ������ԽС�뾶Խ��
��6��H��O��NaԪ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ�����Ϊ�������ƣ�
��7���ݡ��ޡ��������������Ӧˮ����ֱ�Ϊ�������ơ����������������ᣬ�ݴ���д����ʽ��
��� �⣺��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪP����Ϊ Cl��
��1����Ϊ Cl��ԭ�Ӻ��������Ϊ17�����������Ϊ2��8��7��ԭ�ӽṹʾ��ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
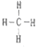
��2������ΪC����̬�⻯��ΪCH4���ṹʽΪ ����ΪP������������ˮ����ķ���ʽΪH3PO4���ʴ�Ϊ��
����ΪP������������ˮ����ķ���ʽΪH3PO4���ʴ�Ϊ�� ��H3PO4��
��H3PO4��
��3���ڡ��۷ֱ�ΪC��N���ǽ�����N��C��������������Ӧˮ���������HNO3��H2CO3���ʴ�Ϊ��HNO3��H2CO3��
��4���ݡ���Ԫ�طֱ�ΪNa��Al��ͬ���ڴ����ҽ����Լ������������ƴ��������ʴ�Ϊ����С��
��5�����Ӳ���Խ�࣬�뾶Խ����ͬ���Ӳ�����ԭ������ԽС�뾶Խ�ܡ��ݡ����γɵļ����ӷֱ�ΪO2-��Na+��Al3+���뾶���μ�С���ʴ�Ϊ����С��
��6��H��O��NaԪ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ�����Ϊ�������ƣ�����ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��7���ݡ��ޡ��������������Ӧˮ����ֱ�Ϊ�������ơ����������������ᣬ������Ӧ���ӷ���ʽ�ֱ�ΪAl��OH��3+OH-=AlO2-+2H2O��H++OH-=H2O��Al��OH��3+3H+=Al3++3H2O���ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��H++OH-=H2O��Al��OH��3+3H+=Al3++3H2O��
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɡ�Ԫ�ػ��������ʣ���������Ԫ�����ڱ��Ľṹ��ע��Ի���֪ʶ���������գ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
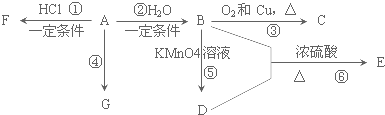
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ȥ�Ҵ��е����� | B�� |  �γ�ԭ��� | ||
| C�� | 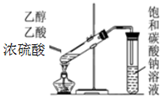 ��ȡ�������� | D�� |  �ռ�NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L CH4�к��з��ӵ���ĿΪNA | |
| B�� | ��״���£�2.24 L Cl2����������Ӧ��ת�Ƶ��ӵ���ĿΪ0.3NA | |
| C�� | ���³�ѹ�£�46 g NO2��N2O4��������к��е�ԭ����Ϊ3NA | |
| D�� | ��״���£�2.24 LCO2������þ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | G+H=W������������ͬʱ���ֱ���200���100���½��з�Ӧ | |
| B�� | ��ͬ�¶��£�������ͬ��п���ֱ���H+Ũ����ͬ����������ᷴӦ | |
| C�� | A+B=C��500���½��У� D+E=F��100���½��У� | |
| D�� | ��ͬ�¶��£�п�������۷ֱ���ͬŨ�ȵ����ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������
����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������| A�� | ������������������ƣ�����������ⷴӦ2OH--2e-�TH2��+O2�� | |
| B�� | ��•�����˷�����ԭ�����������Ļ�ԭ�Ա���ǿ | |
| C�� | ����ά�����•�����˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ���������ͬ | |
| D�� | Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ����ƣ�����ͼ����������ʯī��Ϊ��������Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ũ�ȶ����� | B�� | ����������Ũ�ȶ����� | ||
| C�� | �����Ũ�ȼ�С�������Ũ������ | D�� | �����Ũ�����������Ũ�ȼ�С |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com