
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
分析 A、根据气体的分子数N=$\frac{V}{Vm}$NA;
B、根据氯气和铁反应后变为-1价来分析;
C、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
D、求出二氧化碳的物质的量,然后根据与镁反应后碳元素变为0价来分析;
解答 解:A、标况下,22.4L甲烷中含有的甲烷气体的分子数N=$\frac{V}{Vm}$NA=$\frac{22.4L}{22.4L/mol}$NA=NA,故A正确;
B、标况下,2.24L氯气的物质的量为0.1mol,而反应后氯元素为-1价,则1mol氯气转移2mol电子,故0.1mol氯气转移0.2mol电子即0.2NA个,故B错误;
C、N02和N204的最简式均为NO2,故46g混合物中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,则混合气体中含有3mol原子即3NA个,故C正确;
D、标况下,2.24L二氧化碳的物质的量为0.1mol,与镁反应后碳元素变为0价,则1mol二氧化碳转移4mol电子,故0.1mol二氧化碳转移0.4mol电子即0.4NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数数的有关计算,掌握公式的应用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
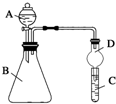 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
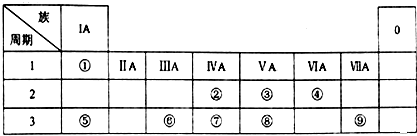
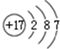 .
.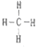 ⑧的最高价氧化物的水化物的分子式H3PO4.
⑧的最高价氧化物的水化物的分子式H3PO4. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
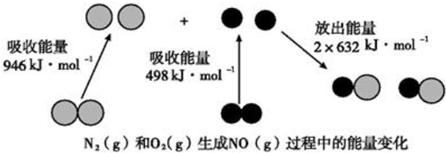
| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
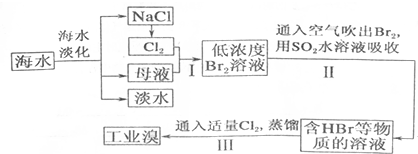
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.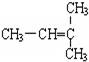 和
和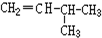
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com