
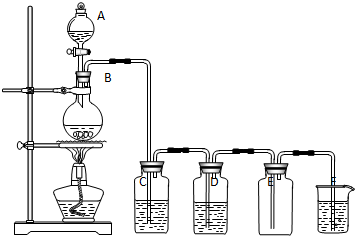
| A�� | ��ϴ��Һ�еμ��Ȼ�����Һ�ɼ�������Ƿ�ϴ�Ӹɾ� | |
| B�� | �����仯�����а����˷ֽ⡢���ϡ����ֽ⡢�û������ַ�Ӧ���� | |
| C�� | ��������Ȼ����������м��Ⱦ����Ŀ����Ϊ�˷�ֹ�Ȼ�þˮ�� | |
| D�� | �����Ҳ���Բ��õ�����ˮ��Һ�ķ��� |
���� ��̼��Ƹ��·ֽ����������ƺͶ�����̼��
���ں�ˮ�м�����ʯ�ң��õ�������þ��
��������þ�����ᷴӦ�õ��Ȼ�þ��
�����Ȼ����������м����Ȼ�þ����õ���ˮ�Ȼ�þ��
�ݵ�������Ȼ�þ�õ�����þ��
A���������Ϻ��е�����������ҪΪ�����ӣ�Ӧ��ϴ��Һ�еμ�̼������Һ������������ɫ��������˵��������ϴ�Ӹɾ���
B���ٷ�Ӧ��̼��Ʒֽ⣬�������ƺ�ˮ��Ӧ�����������ƣ���������þ�����ᷴӦ�����Ȼ�þ��ˮ�����Ȼ�þ�ᾧˮ����ֽ������Ȼ�þ��ˮ���ݵ���Ȼ�þ��Һ������������ʧ�����������������������ӵõ�����������������Һ������������þ������
C���Ȼ�þ��Һ�м���þ����ˮ������������þ��
D������Ȼ�þ��Һ������������ʧ�����������������������ӵõ�����������������Һ������������þ������
��� �⣺A���������Ϻ��е�����������ҪΪ�����ӣ���ϴ��Һ�еμ�̼������Һ������������ɫ��������˵��������ϴ�Ӹɾ�������ϴ��Һ�еμ��Ȼ�����Һ���ɼ�������Ƿ�ϴ�Ӹɾ�����A����
B����Ϊ�ֽⷴӦ�����漰���Ϸ�Ӧ�����ֽⷴӦ����Ϊ���ֽⷴӦ����Ϊ�ֽⷴӦ����Ϊ�ֽⷴӦ�������仯���������û���Ӧ����B����
C���Ȼ����������и��ᄃ���Ŀ����Ϊ�˷�ֹ�Ȼ�þˮ������������þ������ò�����ˮ�Ȼ�þ����C��ȷ��
D������Ȼ�þ��ˮ��Һ���ò�������þ�������ķ�Ӧ�ķ���ʽΪMgCl2+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+Mg��OH��2������D����
��ѡC��
���� ���⿼���˴Ӻ�ˮ�л��þ���������̷�������ˮ�ۺ������Ǹ߿��������ͣ�ע������з����ķ�Ӧ�����жϣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L CH4�к��з��ӵ���ĿΪNA | |
| B�� | ��״���£�2.24 L Cl2����������Ӧ��ת�Ƶ��ӵ���ĿΪ0.3NA | |
| C�� | ���³�ѹ�£�46 g NO2��N2O4��������к��е�ԭ����Ϊ3NA | |
| D�� | ��״���£�2.24 LCO2������þ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ������KOH�����ʵ���Ũ�Ȳ��� | |
| B�� | ������ӦΪ14H2O+7O2+28e-=28OH- | |
| C�� | �ŵ�һ��ʱ�������Χ��pH���� | |
| D�� | ÿ����1mol C2H6�����·��ת�Ƶĵ���Ϊ14mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������
����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������| A�� | ������������������ƣ�����������ⷴӦ2OH--2e-�TH2��+O2�� | |
| B�� | ��•�����˷�����ԭ�����������Ļ�ԭ�Ա���ǿ | |
| C�� | ����ά�����•�����˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ���������ͬ | |
| D�� | Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ����ƣ�����ͼ����������ʯī��Ϊ��������Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ����Ȼ����LNG����װҺ��ʯ������LPG����Ҫ�ɷֶ��������� | |
| B�� | ú����������Եõ���̿��ú���͵Ȳ�Ʒ������ú���Ϳ��Ի�ö��ַ����� | |
| C�� | ʯ���ѻ�����ҪĿ�����������Һ��ȼ�ϵIJ��������� | |
| D�� | ʯ�͵ķ���ú��Һ����ú���������������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
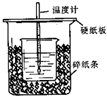 ��֪ϡ������ϡ�ļ���кͷ�Ӧ������1molˮ���ų����Ƚ��к��ȣ���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��֪ϡ������ϡ�ļ���кͷ�Ӧ������1molˮ���ų����Ƚ��к��ȣ���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺| ʵ����� | ����¶� | ����¶� | ��Ӧ����¶� |
| 1 | 21.5�� | 20.5�� | 24.3�� |
| 2 | 21.5�� | 21.5�� | 25.0�� |
| 3 | 16.0�� | 18.5�� | 21.5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹpH��ֽ������ɫ����Һ��Na+��K+��I-��NO${\;}_{3}^{-}$ | |
| B�� | 0.1mol•L-1��Ca��ClO��2��Һ��K+��Na+��I-��Cl- | |
| C�� | ��ʹ�����Ժ�ɫ����Һ��K+��Fe2+��Cl-��NO${\;}_{3}^{-}$ | |
| D�� | ��KSCN�Ժ�ɫ����Һ��Na+��Mg2+��I-��SO${\;}_{4}^{2-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
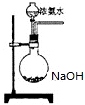 ���ڹ�����ռ����Ҫ��λ��
���ڹ�����ռ����Ҫ��λ��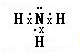 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com