
| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
分析 该燃料电池中,乙烷失电子发生氧化反应,应为原电池负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,据此分析解答该题.
解答 解:该燃料电池中,乙烷失电子发生氧化反应,应为原电池负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O.
A.该电池总反应为2C2H6+7O2+8KOH═4K2CO3+10H2O,有水生成,导致溶液体积增大,KOH参加反应导致物质的量减少,所以KOH浓度降低,故A错误;
B.负极发生氧化反应,应为C2H6+18OH--14e-=2CO32-+12H2O,故B错误;
C.电池工作过程中,负极反应为C2H6+18OH--14e-=2CO32-+12H2O,反应消耗OH-离子,溶液的pH值逐渐减小,故C错误;
D.负极电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,由电极方程式可知每消耗1molC2H6,则电路上转移的电子为14mol,故D正确;
故选D.
点评 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性变化,正确书写电极方程式为解答该题的关键.


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
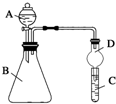 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
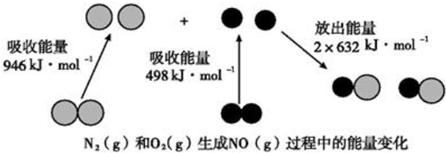
| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
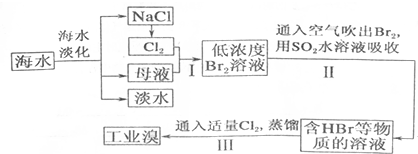
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
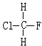 与
与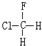 B.
B.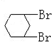 与
与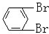 C.
C.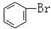 与
与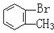 D.
D.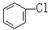 与
与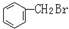 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.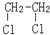 与CH3-CH2Cl.
与CH3-CH2Cl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com