
| �ɷ� | ������mg•L-1�� | �ɷ� | ������mg•L-1�� |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
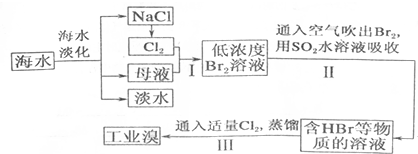
���� ��ˮ�����õ��Ȼ��ƣ��缫�Ȼ�����Һ������״̬�Ȼ��ƻ���������������ͨ��ĸҺ�з�����Ӧ�õ���Ũ�ȵ��嵥����Һ��ͨ���ȿ����������ö�������ˮ��Һ���յõ���HBr�͵���Һ��ͨ���������������õ��嵥�ʣ�������Ԫ�أ�����õ���ҵ�壬
��1�����ݵ�����ˮ�ķ�������������Ŀǰ������ˮ�ķ����У������ᾧ��������Ĥ�����༶�������ȣ�������õ�������
��2����������������������������嵥�ʣ�
��3����ˮ�����õ���ĸҺ�͵���Ȼ�����Һ���ɵ�������Ӧ���õ����嵥��Ũ�ȵͣ��嵥����ˮ����һ�����ܽ����Һ�ˮ��Ӧ����ȡʱ���Ĺ�����Դ��ԭ�ϣ������˾���Ч�棻
��4������������л�ԭ�ԡ��嵥�ʾ��������ԣ����߷���������ԭ��Ӧ����ǿ��HBr��H2SO4���ɣ�
��5������ͼ������Ԫ�غ���Ϊ64mg/L��10m3��ˮ�к���Ԫ��=10��1000L��64g/L��10-3=640g�����ʵ���=$\frac{640g}{80g/mol}$=8mol�����ݷ�Ӧ����õ���2Br-+Cl2=Br2+2Cl-�������������ʵ���Ϊ��4mol����ȡ��������Ҫ����ͨ������ʵ�������ӱ�������
��� �⣺��1��Ŀǰ������ˮ�ķ����ж��֣��磺�������������������ӽ�������ˮ������ܼ���ȡ���ͱ�������
�ʴ�Ϊ��������������������ӽ������ȣ�
��2����������������������������嵥�ʣ���Ӧ�����ӷ���ʽΪ��Cl2+2Br-=Br2+2Cl-��
�ʴ�Ϊ��Cl2+2Br-=Br2+2Cl-��
��3����������ѻ��Br2����������ֽ�Br2��ԭΪBr-��Ŀ���ǵ�Ũ�ȵ�Br2��Һ����ȡʱ���Ĺ����ԭ�Ϻ���Դ��ת��ΪHBr���ױ���������������Ϊ�嵥�ʣ����ڸ�����Ԫ�أ�
�ʴ�Ϊ��������Ԫ�أ�
��4������II��SO2ˮ��Һ����Br2�������ʿɴ�95%���������������嵥�ʷ�����Ӧ��Br2+SO2+2H2O�T4H++SO42-+2Br-��
�ʴ�Ϊ��SO2+Br2+2H2O�T4H++2Br-+SO42-��
��5������10m3��ˮ�е���Ԫ��ת��Ϊ��ҵ�壬����ͼ������Ԫ�غ���Ϊ64mg/L��10m3��ˮ�к���Ԫ��=10��1000L��64g/L��10-3=640g�����ʵ���=$\frac{640g}{80g/mol}$=8mol�����ݷ�Ӧ����õ���2Br-+Cl2=Br2+2Cl-�������������ʵ���Ϊ��4mol����ȡ��������Ҫ����ͨ������ʵ�������ӱ�����������������Ҫ��״����Cl2�����ʵ���Ϊ8 mol��״�������Ϊ 8mol��22.4L/mol=179.2L��
�ʴ�Ϊ��179.2��
���� ���⿼���˺�ˮ�����ĵ�����ԭ���ķ����жϣ���ˮ�������ȡ���̣���Һ�еõ����������Ӧ�ã���Ӧ�����е����������㣬ע�����������������ģ���Ŀ�Ѷ��еȣ�


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ȼ�գ����� CO2 �� H2O | |
| B�� | �ڶ��ױ������������ڷ�������ͬ���칹�� | |
| C�� | ��ϩ����Ȳ�����ӳɷ�Ӧ���ڶ��ױ��ܷ���ȡ����Ӧ | |
| D�� | ��ϩ����Ȳ��ʹ���� KMnO4 ��Һ��ɫ�����ڶ��ױ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L CH4�к��з��ӵ���ĿΪNA | |
| B�� | ��״���£�2.24 L Cl2����������Ӧ��ת�Ƶ��ӵ���ĿΪ0.3NA | |
| C�� | ���³�ѹ�£�46 g NO2��N2O4��������к��е�ԭ����Ϊ3NA | |
| D�� | ��״���£�2.24 LCO2������þ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | G+H=W������������ͬʱ���ֱ���200���100���½��з�Ӧ | |
| B�� | ��ͬ�¶��£�������ͬ��п���ֱ���H+Ũ����ͬ����������ᷴӦ | |
| C�� | A+B=C��500���½��У� D+E=F��100���½��У� | |
| D�� | ��ͬ�¶��£�п�������۷ֱ���ͬŨ�ȵ����ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ������KOH�����ʵ���Ũ�Ȳ��� | |
| B�� | ������ӦΪ14H2O+7O2+28e-=28OH- | |
| C�� | �ŵ�һ��ʱ�������Χ��pH���� | |
| D�� | ÿ����1mol C2H6�����·��ת�Ƶĵ���Ϊ14mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������
����1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH���ۣ�$\frac{\underline{\;���\;}}{\;}$4Na+O2��+2H2O��������•����������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH$\frac{\underline{\;1100��\;}}{\;}$Fe3O4+2H2��+4Na���������й�˵����ȷ���ǣ�������| A�� | ������������������ƣ�����������ⷴӦ2OH--2e-�TH2��+O2�� | |
| B�� | ��•�����˷�����ԭ�����������Ļ�ԭ�Ա���ǿ | |
| C�� | ����ά�����•�����˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ���������ͬ | |
| D�� | Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ����ƣ�����ͼ����������ʯī��Ϊ��������Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
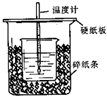 ��֪ϡ������ϡ�ļ���кͷ�Ӧ������1molˮ���ų����Ƚ��к��ȣ���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��֪ϡ������ϡ�ļ���кͷ�Ӧ������1molˮ���ų����Ƚ��к��ȣ���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺| ʵ����� | ����¶� | ����¶� | ��Ӧ����¶� |
| 1 | 21.5�� | 20.5�� | 24.3�� |
| 2 | 21.5�� | 21.5�� | 25.0�� |
| 3 | 16.0�� | 18.5�� | 21.5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com