
| A. | 都能燃烧,生成 CO2 和 H2O | |
| B. | 邻二甲苯另有三种属于芳香烃的同分异构体 | |
| C. | 乙烯和乙炔易发生加成反应,邻二甲苯能发生取代反应 | |
| D. | 乙烯和乙炔易使酸性 KMnO4 溶液褪色,而邻二甲苯不能 |
分析 乙烯、乙炔、邻二甲苯都为烃,含有C、H元素,乙烯含有碳碳双键,乙炔含有碳碳三键,可发生加成、加聚和氧化反应,邻二甲苯含有甲基,可发生取代、氧化反应,以此解答该题.
解答 解:A.都为烃,含有C、H元素,都能燃烧,生成 CO2 和 H2O,故A正确;
B.邻二甲苯的同分异构体有间二甲苯、对二甲苯以及乙苯等,故B正确;
C.乙烯和乙炔含有碳碳不饱和键,易发生加成反应,邻二甲苯的甲基和苯环都能发生取代反应,故C正确;
D.邻二甲苯含有甲基,可被酸性高锰酸钾氧化,故D错误.
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系即可解答,侧重考查基本概念及物质结构,题目难度不大.


科目:高中化学 来源: 题型:解答题
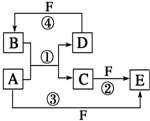 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
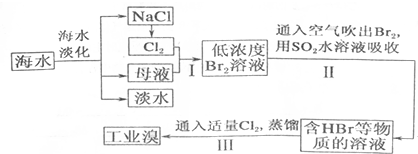
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com