
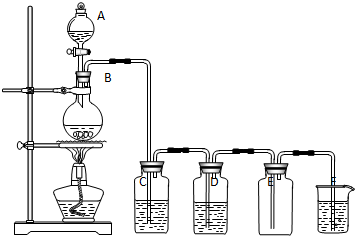
分析 实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气杂质,依次通过饱和食盐水、浓硫酸的洗气瓶先后除去氯化氢和水,注意洗气瓶洗气应长进短出,氯气密度大于水,应采用向上排空气法收集,最后在烧杯中用氢氧化钠溶液吸收氯气,防止污染空气,以此解答该题.
解答 解:实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气杂质,依次通过饱和食盐水、浓硫酸的洗气瓶先后除去氯化氢和水,注意洗气瓶洗气应长进短出,氯气密度大于水,应采用向上排空气法收集,最后在烧杯中用氢氧化钠溶液吸收氯气,防止污染空气,
(1)由装置图可知A为分液漏斗,B为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)因浓盐酸易挥发,C为饱和食盐水,用于除去氯气中的氯化氢,故答案为:饱和食盐水;除去氯化氢气体;
(3)氯气中混有水,D中应盛放浓硫酸,起到干燥的作用,故答案为:浓硫酸;干燥除水;
(4)氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应,则F为氢氧化钠溶液,用于吸收多余的氯气,故答案为:氢氧化钠溶液;吸收多余的氯气;
(5)氯气与氢氧化钠反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题为考查氯气的实验室制法,为高频考点,侧重于学生的分析、实验能力的考查,熟悉实验室制取氯气的反应原理和实验过程是解题关键,注意除杂的顺序,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| B. | 2.4g Mg变为Mg2+时失去的电子数目为0.2NA | |
| C. | 1 L 1mol•L-1 CH3COONa溶液中存在NA个CH3COO- | |
| D. | 1 mol Cn H2n+2含有(3n+2)NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com