
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.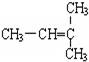 和
和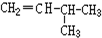
分析 质子数相同,质量数(或中子数)不同的原子互称同位素;
同种元素形成的不同单质互为同素异形体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;
具有相同分子式而结构不同的化合物互为同分异构体;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
解答 解:A.O2和O3都是由氧元素形成的不同单质,故互为同素异形体;
B.D和T质子数相同,中子数不同,故互为同位素;
C.CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,但结构不同,故互为同分异构体;
D.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)CH2CH3是同一物质,
E.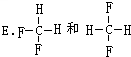 是同一物质;
是同一物质;
F.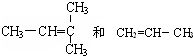 结构相似,分子组成相差2个“CH2”原子团,故互为同系物;
结构相似,分子组成相差2个“CH2”原子团,故互为同系物;
G.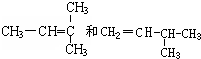 分子式相同,但结构不同,故互为同分异构体;
分子式相同,但结构不同,故互为同分异构体;
故答案为:B;A;F;CG;DE.
点评 本题考查同位素、同素异形体、同系物、同分异构体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
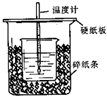 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和硫酸的浓度都增大 | B. | 盐酸和硫酸的浓度都减大 | ||
| C. | 盐酸的浓度减小,硫酸的浓度增大 | D. | 盐酸的浓度增大,硫酸的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.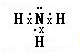 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有甲烷 | B. | 一定含有乙烯 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 一定含有乙烯,不一定含有甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com