
【题目】如图1为实验室制备、收集少量HCl的装置. 
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用图2中的 .
②请解释能用浓硫酸和浓盐酸制备HCl气体的原因 .
③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 .
【答案】c;浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;CCl4
【解析】解:①浓硫酸和浓盐酸混合会挥发出大量HCl,该过程不需要加热,所以选择装置c,所以答案是:c;②浓硫酸具有强吸水性,与浓盐酸混合时会吸收浓盐酸中的水,同时放出大量的热,由于HCl易挥发,硫酸放热促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体,所以答案是:浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;③四氯化碳的密度比水大,而且HCl难溶于四氯化碳,所以装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和CCl4,所以答案是:CCl4.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】在下列氧化还原反应中,水既不作氧化剂又不作还原剂的是( )
①2Na+2H2O=2NaOH+H2↑
②2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
③2F2+2H2O=O2+4HF
④3NO2+H2O=2HNO3+NO
⑤NaH+H2O=NaOH+H2↑
⑥2Na2O2+2H2O=4NaOH+O2↑
A. ③④⑥ B. ②③⑤ C. ①②③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”). 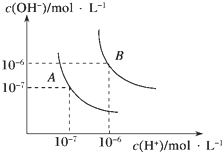
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
气体 | a | b | c | d | |
A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
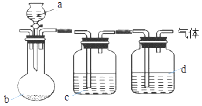
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为: HCOOH ![]() CO↑+H2O.
CO↑+H2O.
如图是制备一氧化碳还原三氧化二铁并检验反应产物结束时的实验装置.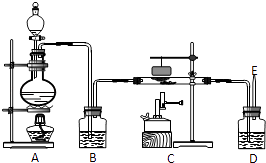
(1)实验前先检查装置的气密性;起始时应检验 , 以防止爆炸;
(2)装置B中盛放 , 除去;
(3)装置D中盛放 , 检验;
(4)写出C装置中反应的化学方程式;
(5)实验结束时应先停止处加热;
(6)在反应后磁铁悬挂在玻璃管上方,其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】33.6gNaHCO3受热分解放出气体在标况下的体积是多少?将放出气体全部通入200mLBa(OH)2溶液中,恰好完全反应,得到沉淀的物质的量是多少?该Ba(OH)2溶液的物质的量浓度是多少?(写出计算过程)_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
(1)图中,A管的作用是 , 制取乙炔的化学方程式为 .
(2)将制得的乙炔通入酸性KMnO4溶液中可观察到的现象是 , 这是由于乙炔发生了 反应.
(3)将制得的乙炔通入溴的四氯化碳溶液中可观察到的现象是 , 这是由于乙炔发生了 反应,写出该反应的化学方程式 .
(4) 为了安全,乙炔气体在点燃前应 , 乙炔燃烧时的现象是 . 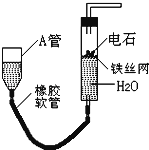
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
A. 硫酸、纯碱、小苏打
B. 磷酸、熟石灰、苛性钠
C. 硫酸氢钠、生石灰、醋酸钠
D. 硫酸、烧碱、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com