
【题目】金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___;其中未成对电子数为___。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___。1mol[Cu(H2O)4]2+中含有σ键的个数为___(NA表示阿伏加德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___,所含元素的电负性大小顺序为___。
(4)金属铜的晶胞结构如图所示。
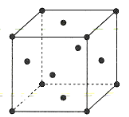
①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___pm(NA表示阿伏加德罗常数的值)。
【答案】灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量 M 1 sp3 12NA 配位键、共价键和离子键 O>S>H>Cu 1:2 ![]() ×
×![]() ×1010
×1010
【解析】
(1)铜盐在灼烧时会产生特殊的颜色,这是由于金属的焰色反应导致的:灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量;
故答案为:灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量;
(2)CuSO4溶液中,金属阳离子的核外电子排布式为:![]() ,最高能层符号是M,3d有5个轨道,根据洪特规则和泡利不相容规则,一个轨道最多容纳2个电子,故有1个未成对电子;
,最高能层符号是M,3d有5个轨道,根据洪特规则和泡利不相容规则,一个轨道最多容纳2个电子,故有1个未成对电子;
故答案为:M;1;
(3)①[Cu(H2O)4]2+中O原子的杂化类型,可直接分析水中氧原子的杂化方式,根据公式计算![]() ,故氧原子采取sp3杂化;1mol[Cu(H2O)4]2+中,每摩尔水含2molσ键,氧和铜形成1mol配位键,故1mol[Cu(H2O)4]2+中含有σ键的个数为12NA;
,故氧原子采取sp3杂化;1mol[Cu(H2O)4]2+中,每摩尔水含2molσ键,氧和铜形成1mol配位键,故1mol[Cu(H2O)4]2+中含有σ键的个数为12NA;
故答案为:sp3;12NA;
②根据CuSO4·5H2O的结构图可知,4个水和铜形成配位键,由原子提供孤对电子,水与硫酸根均含共价键,硫酸铜还含有离子键,故CuSO4·5H2O结构中含有的化学键的类型有配位键、共价键和离子键;根据元素周期律可知,元素周期表越靠近右上位置,电负性越强,故CuSO4·5H2O所含元素的电负性大小顺序为O>S>H>Cu;
故答案为:配位键、共价键和离子键;O>S>H>Cu;
(4)①晶胞中共有同一顶点的3个面心的微粒与顶点微粒形成正四面体,晶胞中正四面体数目为8;面心位置6个微粒围成正八面体,将晶胞补全可知共用1条棱的4个面心与该棱顶点微粒也围成正八面体,而这样的正八面体为4个晶胞共有,晶胞单独占有正八面体数目![]() ,故晶体中正八面体和正四面体空隙数的比值为
,故晶体中正八面体和正四面体空隙数的比值为![]() ;
;
②该硫化铜(CuS)晶体中,硫离子位于8个顶点和6个面心,故1个晶胞中硫离子数为:![]() ,铜离子个数也为4,则晶胞体积:
,铜离子个数也为4,则晶胞体积:![]() (pm3),两个最近的S2-是位于顶点和面心的位置,则两个最近的S2-之间的距离为边长的
(pm3),两个最近的S2-是位于顶点和面心的位置,则两个最近的S2-之间的距离为边长的![]() 倍,最近距离为:
倍,最近距离为:![]() ×
×![]() ×1010;
×1010;
故答案为![]() ×
×![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
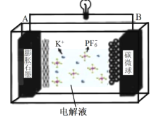
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
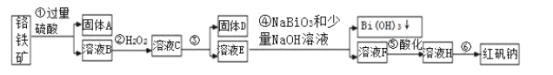
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
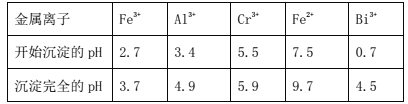
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
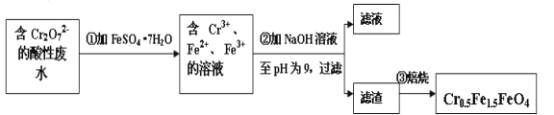
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属有机多孔材料FJI-H14在常温常压下对CO2具有超高的吸附能力,并能高效催化CO2与环氧乙烷衍生物的反应,其工作原理如图所示。下列说法不正确的是( )
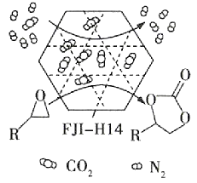
A.该材料的吸附作用具有选择性
B.该方法的广泛使用有助于减少CO2排放
C.在生成 的过程中,有极性共价键形成
的过程中,有极性共价键形成
D.其工作原理只涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1NaHC2O4溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图所示。下列说法错误的是( )
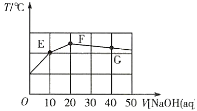
A.E点存在:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-)
B.F点存在:c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4)
C.在E、F和G点中,G点对应的Kw最小
D.G点对应的溶液中,c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是一种医药合成中间体,实验室以芳香烃A为原料制备I的路线如图(部分反应条件已省略):

已知:RCH=CH2+HBr![]() RCH2CH2Br。
RCH2CH2Br。
回答下列问题:
(1)X的分子式为C8H8,且X与A互为同系物,则X的化学名称是___。
(2)B生成C的反应类型是___,B、C含有的相同的官能团名称是___。
(3)碳原子上连有4个不同原子或基团时,该碳原子为手性碳原子。写出D的结构简式,并用星号(*)标出其中的手性碳原子___。
(4)设计实验检验有机物E中的含氧官能团:___。
(5)G的结构简式是___。
(6)Y与C是同分异构体,Y中含苯环,且苯环上有2个取代基,Y能发生银镜反应,其核磁共振氢谱中有5组峰,且峰面积之比为6:2:2:1:1,则Y的结构简式为___。
(7)丙二酸(HOOCO2COOH)主要用作医药合成中间体、电镀抛光剂等。设计以丙烯(CH3CH=CH2)和 为原料制备丙二酸的合成路线:___(无机试剂任选)。
为原料制备丙二酸的合成路线:___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L 甲苯所含的分子数约为NA
B.室温下,2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
C.1 mol C3H8 分子中含有共价键的数目为 9 NA
D.1 mol 氯气和足量甲烷在光照条件下反应可生成 2 NA 个氯化氢分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1C时,向固定体积密闭容器中通入2mol SO2和1molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)+197 kJ一段时间后,将反应体系温度瞬间升至T2C,并开始连续测定体系内SO3的物质的量浓度并绘制其与时间t的变化关系示意图。下列示意图一定不可能出现的是( )
2SO3(g)+197 kJ一段时间后,将反应体系温度瞬间升至T2C,并开始连续测定体系内SO3的物质的量浓度并绘制其与时间t的变化关系示意图。下列示意图一定不可能出现的是( )
A.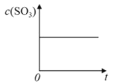 B.
B.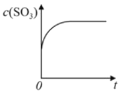 C.
C.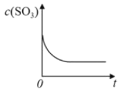 D.
D.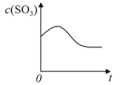
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某浓度H2A溶液中滴加NaOH溶液,若定义pC=﹣lgC,则测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( )
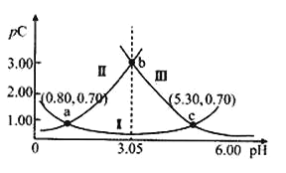
A.曲线II表示pC(HA-)随pH的变化
B.常温下,![]() =104.50
=104.50
C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D.a、b、c三点对应的溶液,c(HA-)+c(A2-)+c(HA)始终不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com