
| A、2H2O+O2+4e→4OH- |
| B、Fe2++2OH-→Fe(OH)2↓ |
| C、Fe-3e→Fe3+ |
| D、4Fe(OH)2+O2+2H2O→4Fe(OH)3↓ |


科目:高中化学 来源: 题型:
| A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B、用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C、配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| E、Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中 |
| F、将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、氯化氢水溶液能导电,所以氯化氢是电解质 |
| C、CO2溶于水能导电,所以 CO2是电解质 |
| D、铜丝能导电,所以铜是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| B、用75%的乙醇溶液进行消毒,是由于乙醇能使蛋白质变性 |
| C、用铁制容器储运浓硫酸或浓硝酸,是由于铁与浓硫酸或浓硝酸不反应 |
| D、向Na2O2与水完全反应后的溶液中加MnO2产生O2,可能该溶液中含H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | (40~50)mg/kg(以I计) |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
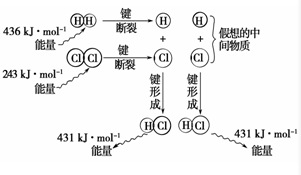 实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 |
| B、胶体是纯净物 |
| C、光线透过胶体时,胶体中可发生丁达尔效应 |
| D、Fe(OH)3胶体能吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
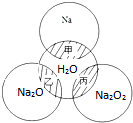 如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲、乙、丙表示圆圈内物质相互发生的反应,钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、甲、乙、丙都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂时H2O |
| C、丙反应中消耗1molNa2O2,则转移1mol电子 |
| D、若甲、乙、丙反应后所得溶液的质量分数分别为w1、w2、w3,则:2w1=w2=w3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com